 2021.06.15
2021.06.15  2267次
2267次
竞争的内源性RNA(ceRNA)假设提出:具有共享的microRNA(miRNA)结合位点的转录本竞争转录后抑制。这一假设获得了大量的关注,因为长非编码RNA( long non-coding RNAs)、伪基因转录本( pseudogene transcripts)和环状RNA(circular RNAs),同样是作为信使RNA(mRNA)的一种替代功能。支持这一假设的实证证据正在积累,但并非没有引起怀疑的态度。澳大利亚的加文医学研究所的Daniel W. Thomson曾模拟转录组全范围内结合位点丰度的研究表明,大多数转录本表达的生理变化不会损害miRNA的活性。在这篇综述中,作者批判性地评估了支持和反对ceRNA假说的证据,以评估内源性miRNA-海绵相互作用的影响。

结果展示
1.ceRNA机制假说示意图
A.当竞争的内源性RNA(ceRNA),如伪基因,保持转录沉默(不转录)时,父本mRNA被转录并运输到细胞质中,成为microRNA诱导的沉默复合物(miRNA-RISC)的靶向目标,导致mRNA加速降解、阻断翻译和蛋白表达下降。
B.当具有竞争靶位点(红色)的伪基因具有转录活性时,它会竞争miRNA靶向和RISC复合物的结合。该伪基因的RNA序列使miRNA-RISC复合物远离父本基因mRNA序列,进而并导致父本基因表达增加。AGO, Argonaute蛋白(RISCs复合物的主要成员) ;PolII,RNA聚合酶II(基因转录酶)。
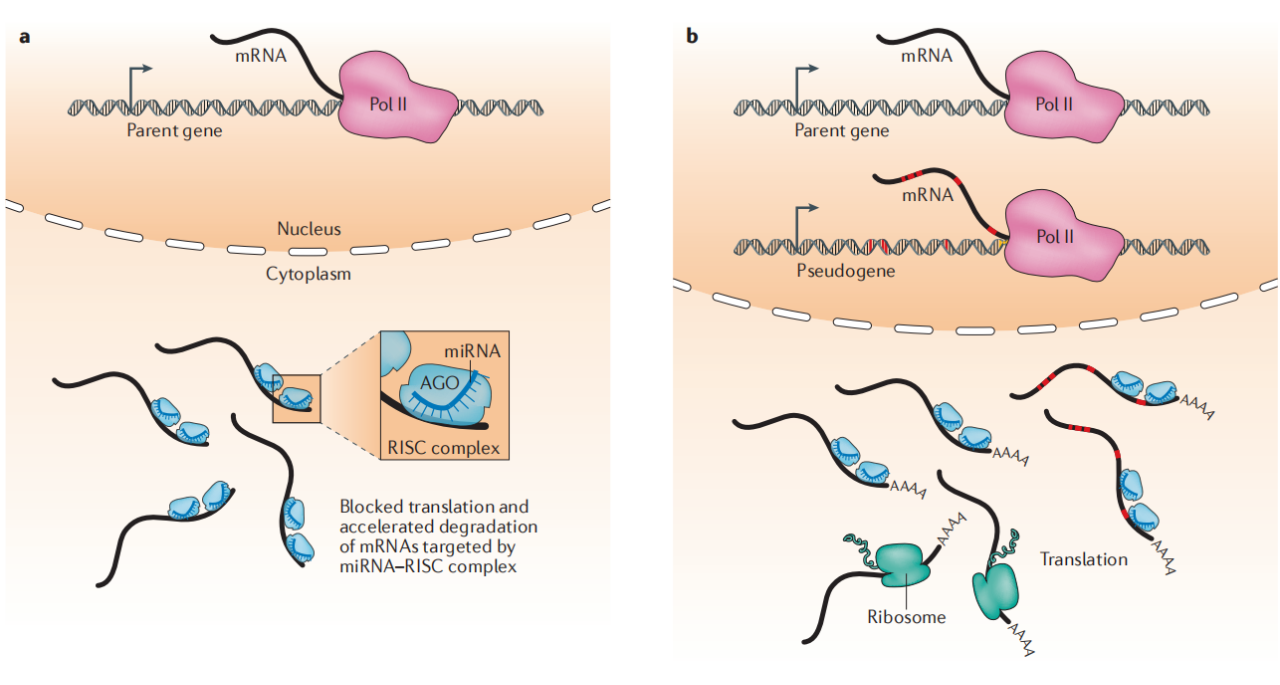
图1.竞争的内源性RNA(ceRNA)作用机制
正常基因的转录翻译过程:细胞核DNA转录并剪接成成熟的mRNA,运输到细胞质中,与核糖体结合病翻译成蛋白多肽序列。翻译后的修饰过程我们暂且不讨论。ceRNA网络发生影响的场景是核酸水平事件(即转录与翻译之间)。其中众多的microRNA(miRNA)在此过程中担任是一个调控角色(负反馈调节)。miRNA能与mRNA的3‘UTR特异性结合,进而导致mRNA加速降解、阻断翻译和蛋白表达下降。本文中讲述的ceRNA网络,除了mRNA,miRNA之外,还有谁参与呢?它们又是扮演着什么角色?如何进行的呢?
2.能与microRNA竞争结合的活性转录组
基因组编码不同类型的RNA,包括mRNA、环状RNA(circRNA)、表达3′未翻译区域(3’UTR)、伪基因和长非编码RNA(lncRNA)。所有RNA类型的转录构成全部转录组,它们都可以共同竞争miRNA靶向结合。大多数活性转录本能与microRNA靶向结合(即与RNA诱导的沉默复合物(RISC)的结合相关),也包括编码转录本(即mRNAs)。
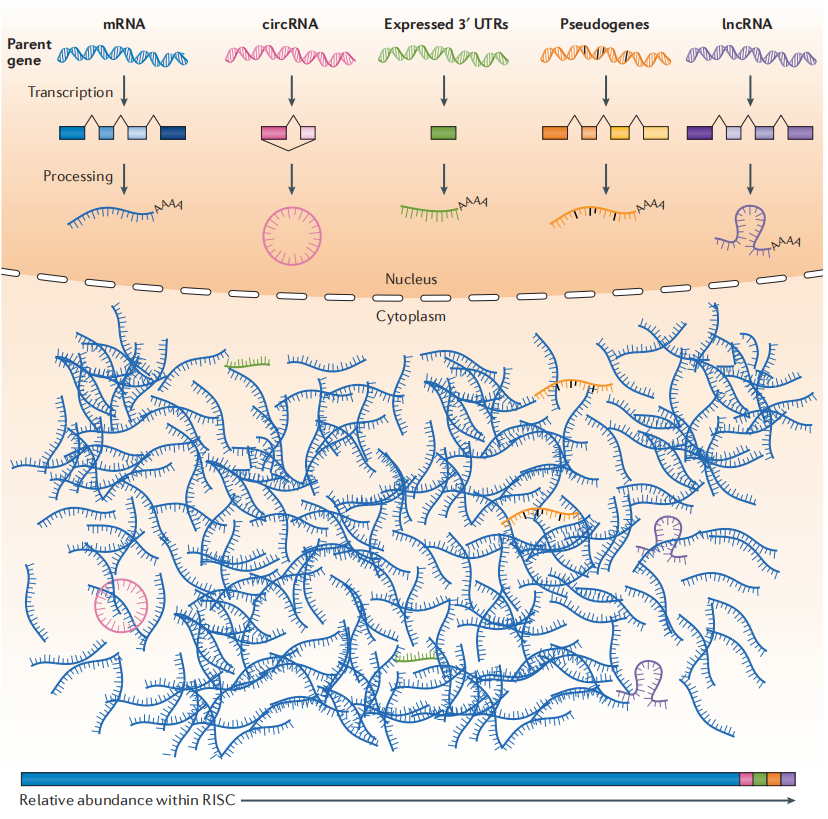
图2.基因组编码的全转录组示意图
ceRNA假说的一个吸引人的方面是,它提供了一种途径,通过识别miRNA结合位点来预测任何未特征RNA转录本的非编码功能。许多蛋白质编码的转录本(即 mRNAs)也通过ceRNA机制产生非编码功能。尽管使用序列搜索算法识别假定的ceRNA相互作用相对容易,实验对于确定真正的miRNA靶点和ceRNA的相互作用至关重要。在目前水平上,识别ceRNA相互作用的实验框架包括表明假定的ceRNA的过度表达会导致竞争转录本的表达增加,或在ceRNA被抑制时观察相互关系。
从上示意图可见,多种转录组产物能与miRNA-RICS复合物相互结合,构成一个ceRNA网络。从数量的角度看,mRNA是主体成份,其余的非编码RNA是次要成分,起调节作用。miRNA主导抑制mRNA的正常翻译表达的作用,剩余的伪基因,长非编码RNA,3’UTR表达区域,环状RNA等则作为竞争者的姿态,帮助mRNA逃脱miRNA的抑制作用,从而上调该基因的表达。俗话有云:敌人的敌人就是朋友!
3.用于评估转录组范围内微RNA结合竞争的策略
A.MicroRNA(miRNA)-靶簇使用靶预测算法不对基因表达进行预测。miRNA-靶簇预测覆盖在基因表达(mRNA)和miRNA表达的数据库中。在预测的miRNA-靶点簇中,生理上的miRNA抑制由miRNAs 证明,其靶点在表达中呈反相关。为了证明同一生物群团内的mRNA靶点在争夺 miRNA靶点,共同的miRNA靶点显示出相关的表达,支持竞争的内源性RNA(ceRNA) 假说。
B. miRNA丰度(例如,用记者分析测定)与miRNA丰度(例如,用小RNA测序(RNA-seq)测定)的相关性较弱。通过测量和比较每个miRNA的目标丰度,可以研究miRNA活性和丰度(表示为*)之间的不相关性。
C.通过miRNA过表达和基因表达分析来识别miRNA靶基因。将下调基因与预测的miRNA靶位点丰度进行比较,能够表明具有较大靶池的过表达的miRNA具有稀释活性。

图3.用于评估转录组范围内微RNA结合竞争的策略示意图
作者从基因表达数据中对ceRNA网络进行建模。原则上,基因受到调控的程度ceRNA可以通过列出所有miRNA-靶对并评估相同 miRNA靶向的mRNA是否在表达中显著更相关来评估。为了支持ceRNA假说,miRNA-靶生物星团中的mRNA与表达相关,提示在常见的靶mRNA中出现表达缓冲。全转录组RNA竞争大的内源性靶池可以降低miRNA的活性。通过比较转录组全靶点丰度预测与miRNA活性的高通量检测,可以观察到大量内源性靶点对miRNA活性的抑制作用。过量表达miRNA在较大目标池的活性会被稀释。测量大量内 源性靶点的抑制效应的一种替代方法是比较预测 的靶点丰度与miRNA过表达后的miRNA靶点抑制作 用(图3c)。使用这种方法,预测的miRNA靶丰度与下调的微阵列数据集进行了比较ceRNA可以通过列出所有miRNA-靶对并评估相同miRNA靶向的mRNA是否在表达中显著更相关来评估。
4.miRNA的相对细胞丰度和预测靶位点的示意图
单个miRNAs(黑线) 的丰度(每个细胞拷贝),其中前10个最丰富的miRNAs构成了所有细胞miRNAs的大多数。每个miRNA预测的miRNA靶位点的总数通常超过了miRNA的丰度。预测的miRNA靶位点包括mRNA(蓝线)、长非编码RNA(lncRNA、紫色线)和伪基因(橙色线)。大多数预测的目标位点都在mRNAs范围内。
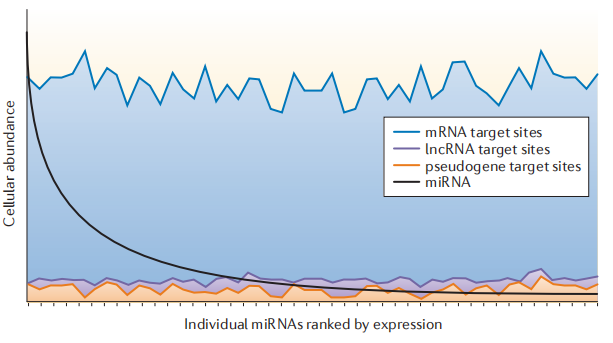
图4.miRNA的相对细胞丰度和预测靶位点的示意图
ceRNA验证的限制不能排除全转录组建模数据和实验验证之间的差异是每种方法的特定限制的结果。在这里,我们总结了用于研究ceRNA机制的实验方法和生物信息学方法的显著局限性。评估ceRNA活性的研究,特别是数学建模研究的一个潜在压倒性的局限性,是它们完全依赖于miRNA-目标预测算法的应用。大家都意识到miRNA预测算法的局限性和不足。例如,许多算法只包括编码转录本的 3‘UTR的靶点预测,就像TargetScan, Probability of Interaction by Target Accessibility (PITA), miRanda等的情况一样. 此外,许多算法依赖于物种之间的守恒,很少考虑到表达水平,在观察ceRNA网络时,通常只研究少量的转录本。
小结
通过ceRNA机制发现lncRNA功能的令人兴奋的前景引起了极大的兴趣。它成功的关键是它作为一种全球机制的潜力。然而,这被证明是一把双刃剑:虽然它可以提供一种机制来解释任何RNA的功能,但它也必须在整个转录组的背景下被仔细审查。理解miRNA和ceRNA的化学计量学是至关重要的,因为miRNA的有效性是由其细胞丰度决定的22 或者,更准确地说,它在RISC复合物中的丰富度。文章中考虑到非编码的RNA时特别相关,这些RNA只占了miRNA靶点总池的一小部分。相反,ceRNA功能增强的模型的澄清可以解释ceRNA活性如何不仅仅表现为其表达的功能,例如ceRNA浓度在空间或时间上富集,以满足ceRNA活性的高表达要求,或者RNA稳定性是否增加。
最后,这篇综述的重点是讲述miRNAs和miRNA靶点之间的竞争;然而,这个发现对于这一领域的工作具有深远的影响,在逆转录的生物过程中,miRNA的抑制作用从可替代性的RNA结合蛋白到内源性的RNA竞争。



 返回列表
返回列表