 2019.05.09
2019.05.09  5630次
5630次
1.纳米材料概述
纳米材料是指在三维空间中至少有一位处于纳米尺度范围(1-100nm)或由它们作为基本单元构成的材料。纳米材料不但具有能穿过组织间隙并被细胞吸收等特性,而且还具有靶向、缓释、高效、低毒且可实现口服、静脉注射及敷贴等多种给药途径等优点。
应用于生物医学中的纳米材料的主要类型及其特性:
1)纳米碳材料:主要包括碳纳米管、气相生长碳纤维也称为纳米碳纤维、类金刚石碳;
2)纳米高分子材料,也称高分子纳米微粒或高分子超微粒,粒径尺度在1nm~1000nm范围。这种粒子具有胶体性、稳定性和优异的吸附性能,可用于药物、基因传递和药物控释载体,以及免疫分析、介入性诊疗等方面;
3)纳米复合材料:无机-无机、有机-无机、有机-有机及生物活性-非生物活性的纳米结构复合材料。
纳米材料在生物医学方面的应用:
•细胞分离、细胞内部染色。
•药物开发:指将原料药物直接加工制成纳米药物晶体或者以纳米材料最为载体利用物理或者化学的方法将药物引入。这种纳米级别的药物,可以使原来只能注射的药物,通过口 服进行给药,且不会影响药物的疗效。
•药物运输:提高药物载体的无毒性和靶向性。
•纳米生物医用材料:伤口敷料、人造皮肤和血管、组织工程支架等
•基因载体:例:二氧化硅在基因治疗方面主要作为基因载体,应用于肿瘤治疗,促进体外小干扰RNA的递送。
•纳米生物探针:探测出单个细胞活性,早期DNA损伤,细胞化学物质变化。
•纳米治疗:磁疗治癌、纳米机器人
2.服务内容(已光热治疗和光动力治疗肿瘤为例)

●纳米材料的制备
用于光热治疗的纳米材料能够在光照条件下吸收光能并转化为热量释放出来,引起周围环境温度升高,肿瘤细胞对温度变化比较敏感,温度高于42℃就开始凋亡,即可局部性的对肿瘤进行治疗。
光动力治疗是药物在光照时与氧气作用产生强氧化性的活性氧物种(ROS)。由于ROS可以对生物分子造成氧化破坏,如蛋白、DNA、磷脂等生物分子,造成细胞氧化压力升高,诱发细胞发生凋亡或病变。因此,利用活性氧的氧化破坏性可以有效杀灭肿瘤细胞。
●纳米材料特性实验
根据材料的特性采用光谱扫描及透射电镜检测纳米材料的光学或者热动力学性质,计算光热转换率;检测光热稳定性。
●体外检测材料安全及有效性
好的纳米材料在无照射的条件下即使作用浓度很高也不会对细胞产生很大的毒性,且细胞能够较好的摄取纳米材料进入胞内。筛选出效果最好的光照波长及光照时间,检测细胞内的ROS生成水平或检测细胞活性及荧光染色来验证体外光热治疗效果,CCK8测定细胞活性。
●纳米材料体内治疗作用验证
纳米材料负载荧光标记,即可检测动物体内的纳米材料的分布聚集情况。将癌细胞接种注射到裸鼠体内,建立肿瘤模型,将纳米材料通过瘤内注射方式对小鼠进行给药。一定时间后将实验小鼠放在近红外激光器光源下光照,通过红外相机记录小鼠肿瘤部位实时温度变化。光热治疗前后监测小鼠肿瘤体积,小鼠体重的变化,并在激光照射后立即取出肿瘤组织进行组织学检测观察肿瘤组织损伤情况。检测肝、脾、肾、心、肺等主要脏器的损伤情况,另可检测纳米材料在血液循环的时间、负载药物的释放效率、材料进入细胞的内吞途径等。
3. 案例
1)光热治疗
本文以聚(3,4-乙基二氧噻吩):聚(4-苯乙烯磺酸盐)(PEDOT:PSS)为基础,研制了一种新型的有机PTT剂,用于肿瘤的体内光热治疗。所得到的PEDOT:PSS-PEG纳米粒子经带电荷聚合物层层包覆,再与支链聚乙二醇(PEG)偶联后,在生理环境中具有很高的稳定性,静脉注射后表现出类似于隐形的行为,具有较长的血液循环半衰期。研究人员进一步将PEDOT:PSS-PEG作为PTT药物用于体内癌症治疗,并在低激光功率密度下近红外照射小鼠肿瘤模型中实现了良好的治疗效果。综合血检和仔细的组织学检查显示,在40天内,PEDOT:PSS-PEG对小鼠没有明显的毒性。
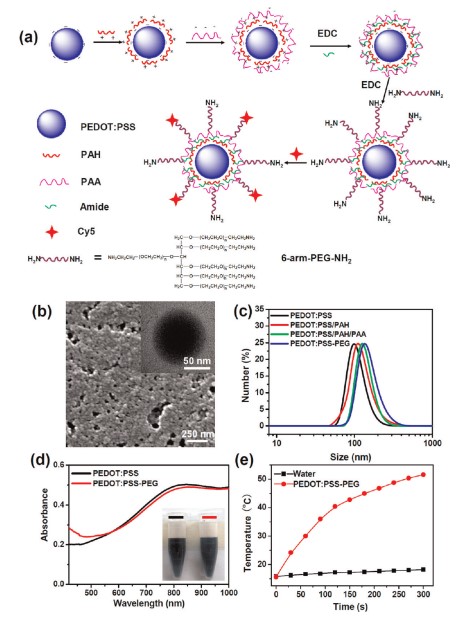
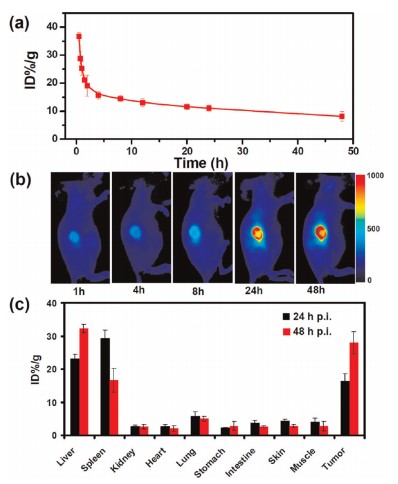
PEDOT:PSS-PEG制备及特性 纳米颗粒体内行为
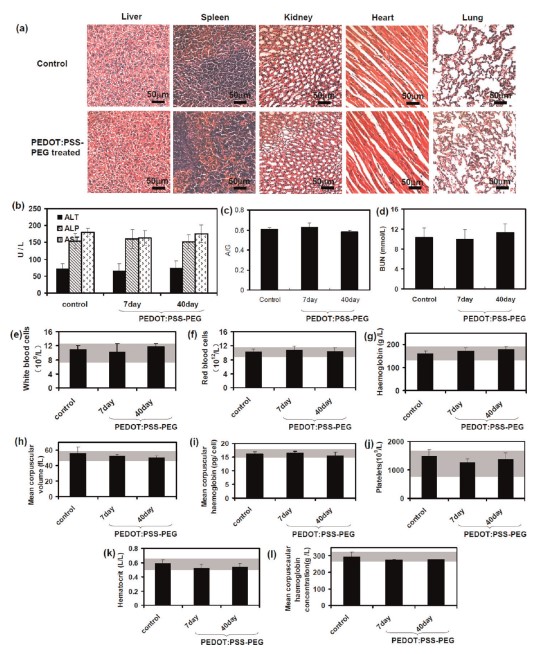
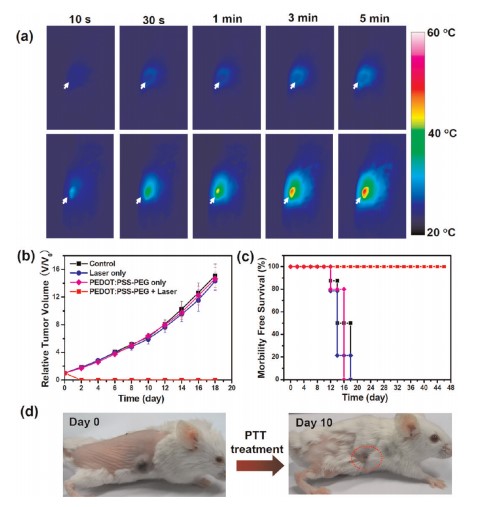
体内光热治疗 体内毒理学研究
Cheng Liang,Yang Kai,Chen Qian et al. Organic stealth nanoparticles for highly effective in vivo near-infrared photothermal therapy of cancer.[J] .ACS Nano, 2012, 6: 5605-13.
1)光动力治疗
研究者制备一种线粒体靶向纳米放射增敏剂激活活性氧,用于强化放射治疗。在x射线照射下,纳米增敏剂可在线粒体中产生活性氧(ROS),从而引起了活性氧爆发的多米诺骨牌效应。过量产生的ROS在线粒体中积累,导致线粒体崩溃和不可逆细胞凋亡。菌落形成实验表明,线粒体靶向纳米增敏剂孵育的细胞存活率明显低于非靶向组。在体内实验表明,肿瘤被明显抑制,即使仅使用一次放疗。
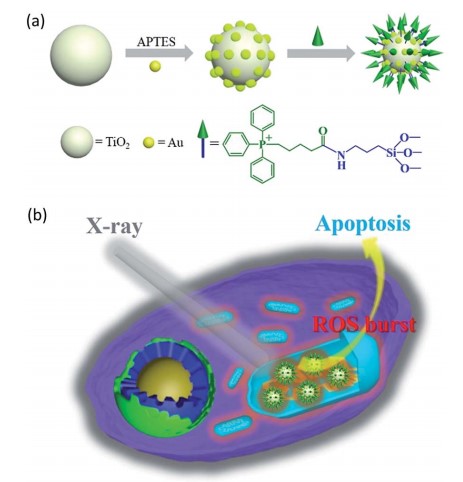
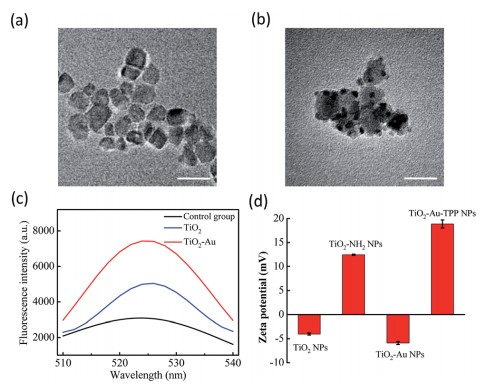
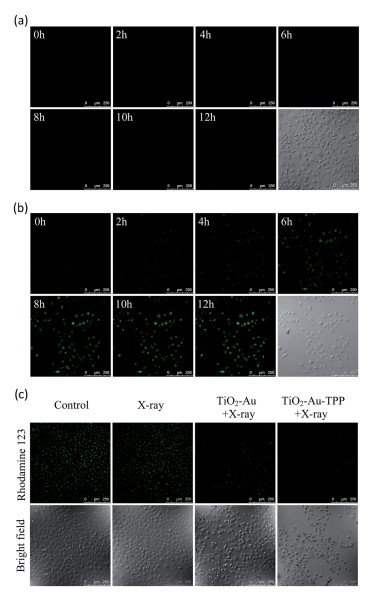
技术路线 纳米放射增敏剂的表征 实时细胞O2.-释放及膜电位检测
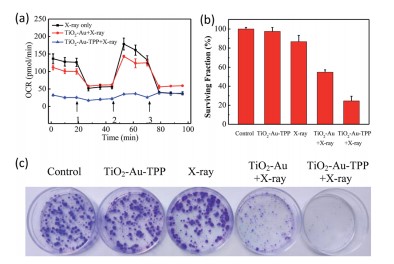
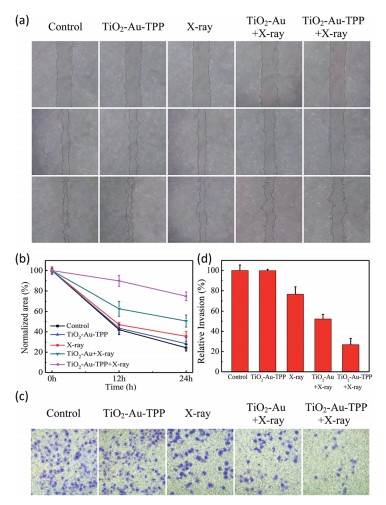
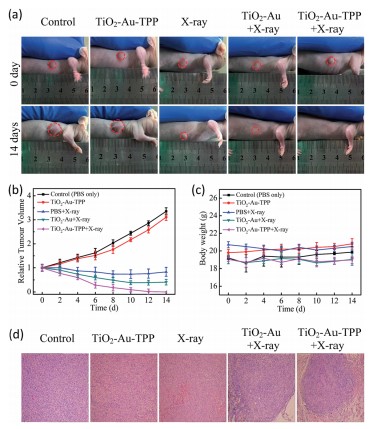
体外治疗作用检测 体内治疗肿瘤
Li Na,Yu Longhai,Wang Jianbo et al. A mitochondria-targeted nanoradiosensitizer activating reactive oxygen species burst for enhanced radiation therapy.[J] .Chem Sci, 2018, 9: 3159-3164.
2月份《德国应用化学》报道了一种基于新型铽(Tb)掺杂钨酸钆纳米闪烁体(GWOT NPs)的多功能纳米诊疗试剂,它不仅实现了对肿瘤组织的双重造影(X射线计算机断层扫描(CT)核磁共振成像(MRI))和对肿瘤组织的X射线激发光动力治疗(X-PDT)及放疗(RT)的协同治疗,同时表现出低生物毒性,表明该新型纳米闪烁体在深部肿瘤的诊断与治疗领域应用前景广阔。
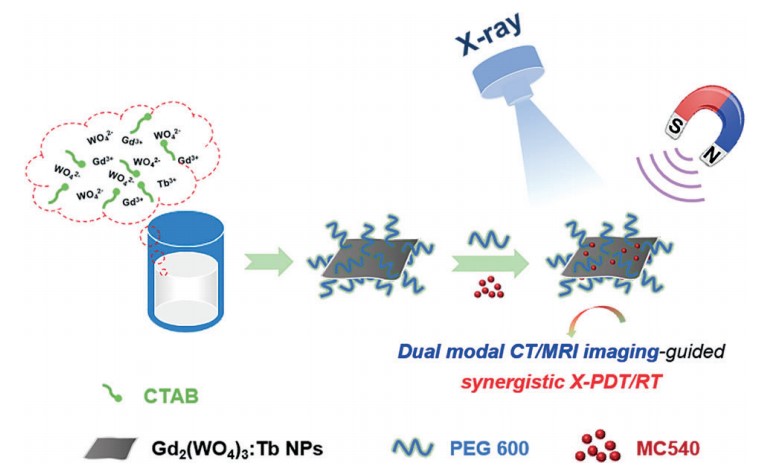
技术路线
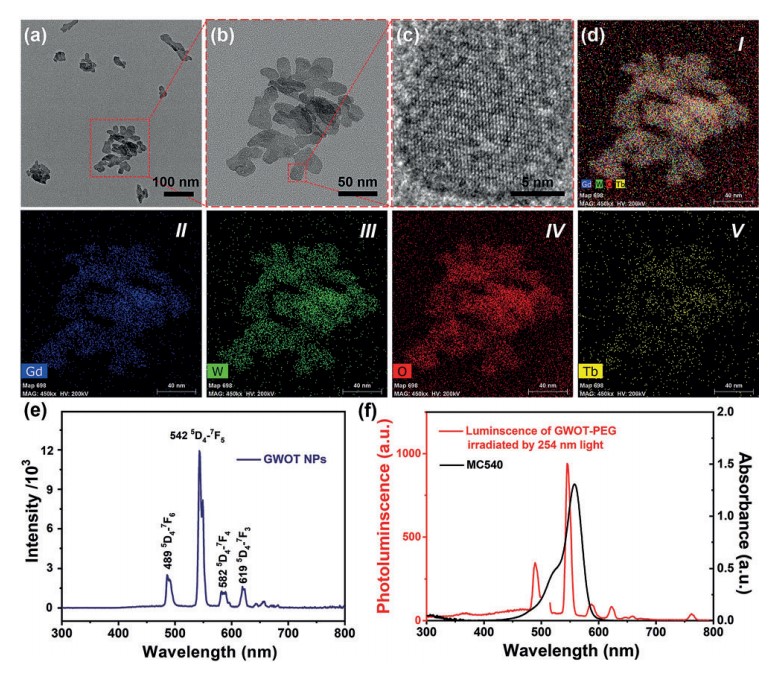
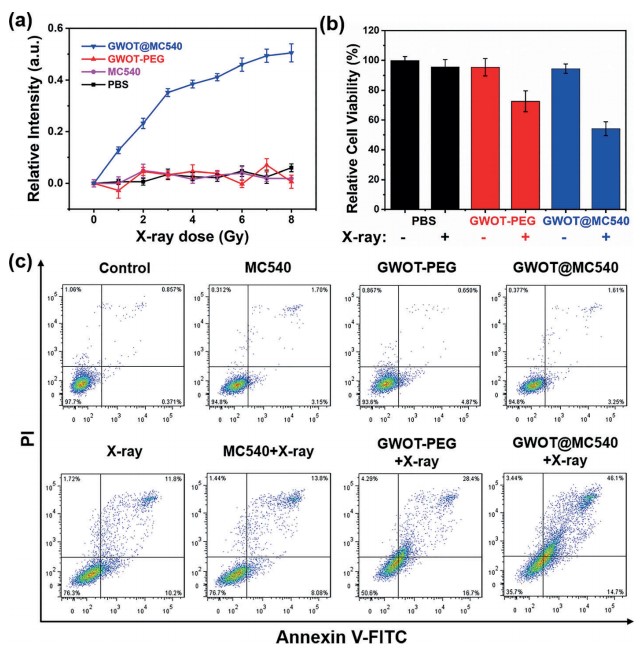
纳米材料表征 细胞活性及凋亡检测
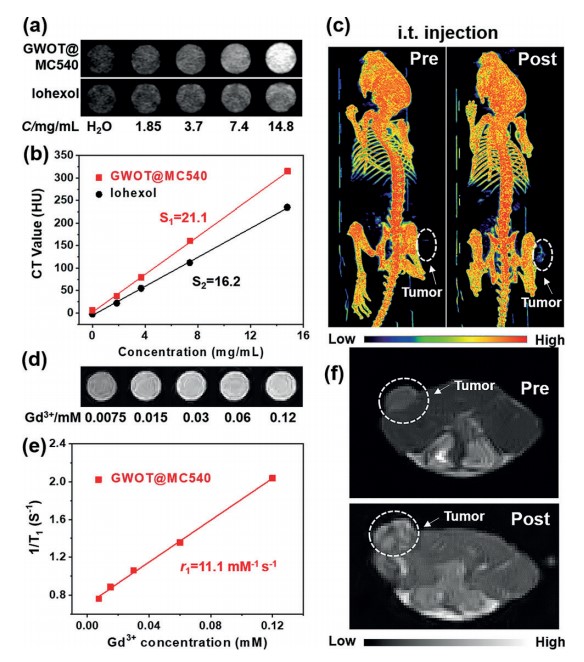
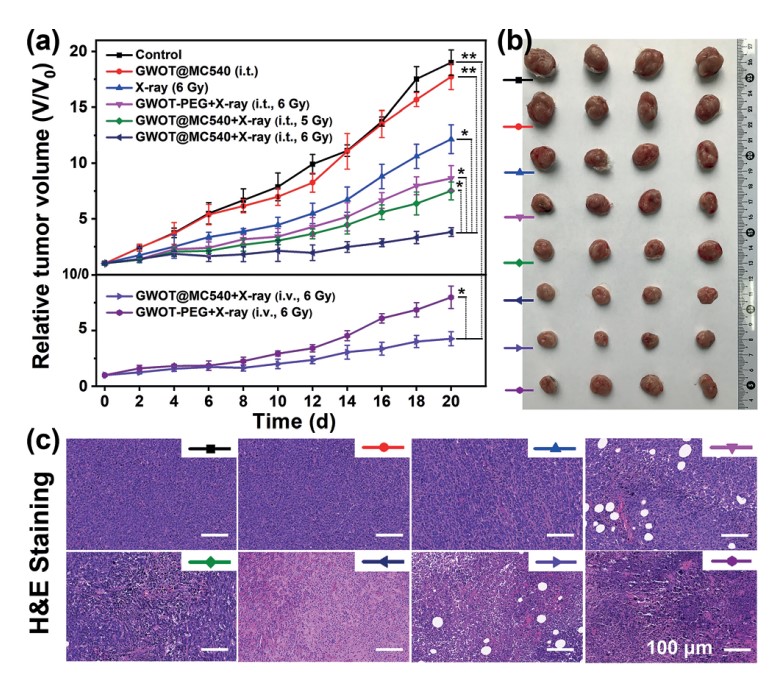
肿瘤组织的双重造影 体内治疗及病理检测
Yu Xujiang,Liu Xinyi,Wu Weijie et al. CT/MRI-Guided Synergistic Radiotherapy and X-ray Inducible Photodynamic Therapy Using Tb-Doped Gd-W-Nanoscintillators.[J] .Angew. Chem. Int. Ed. Engl., 2019, 58: 2017-2022.
其他相关文献
1.Sun Lihong,Li Qian,Hou Mengmeng et al. Light-activatable Chlorin e6 (Ce6)-imbedded erythrocyte membrane vesicles camouflaged Prussian blue nanoparticles for synergistic photothermal and photodynamic therapies of cancer.[J] .Biomater Sci, 2018, 6: 2881-2895.
2.Wang Sheng,Cao Yongbin,Zhang Qin et al. New Application of Old Material: Chinese Traditional Ink for Photothermal Therapy of Metastatic Lymph Nodes.[J] .ACS Omega, 2017, 2: 5170-5178.
3.Jiang Qin,Liu Yao,Guo Ranran et al. Erythrocyte-cancer hybrid membrane-camouflaged melanin nanoparticles for enhancing photothermal therapy efficacy in tumors.[J] .Biomaterials, 2019, 192: 292-308.
4.Ma Yu,Li Xiangyuan,Li Aijie et al. H S-Activable MOF Nanoparticle Photosensitizer for Effective Photodynamic Therapy against Cancer with Controllable Singlet-Oxygen Release.[J] .Angew. Chem. Int. Ed. Engl., 2017, 56: 13752-13756.


