 2020.08.03
2020.08.03  3804次
3804次
m6A研究思路又来了,今天解读一篇发表在Molecular Cancer(IF:15.3)上题为“RNA demethylase ALKBH5 prevents pancreatic cancer progression by posttranscriptional activation of PER1 in an m6A-YTHDF2-dependent manner”的文章。

01 前言
胰腺癌(PC)是一种起病隐匿、早期诊断困难、手术切除率低的胃肠道高恶性肿瘤,是世界上最常见的致命肿瘤之一。患者的5年生存率仅为8%,在发生远处转移后甚至降至3%。因此,迫切需要阐明PC的分子和细胞机制,以达到诊断和治疗干预的目的。N6-methyladenosine (m6A) 是真核生物mRNA中最丰富的可逆甲基化修饰,在肿瘤发生中发挥重要作用。本研究旨在探讨m6A去甲基化酶的作用ALKBH5与胰腺癌(PC)的关系。
02 研究结果
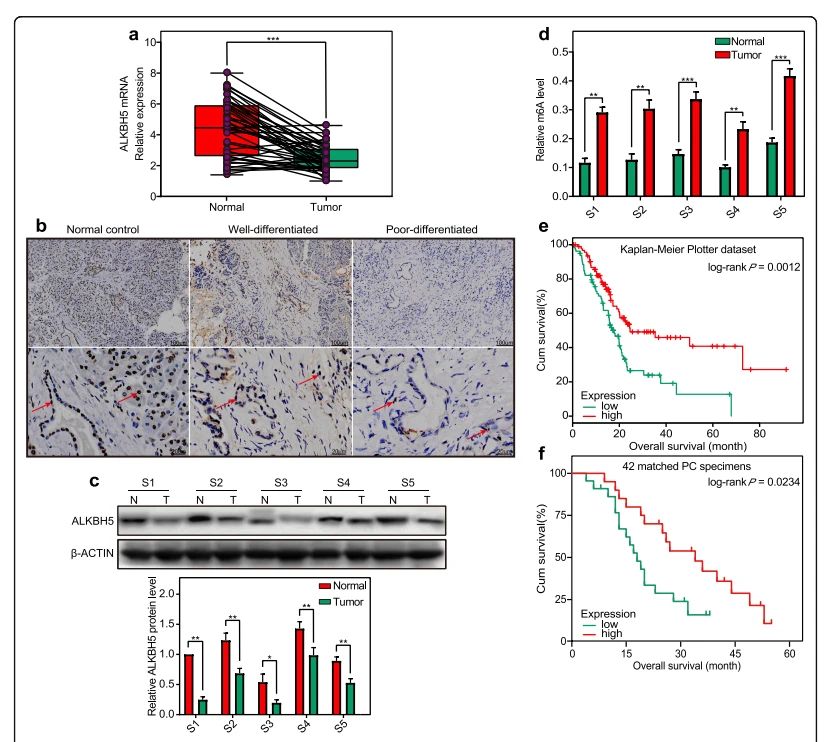
❶ ALKBH5表达减少对PC具有预测和预后价值
作者首先检测了42例胰腺肿瘤和相应非肿瘤性胰腺组织中ALKBH5的表达水平,发现与非癌对照组织相比,ALKBH5表达水平在PC中显著下调;同时,在肿瘤组织中,发现m6A水平的上调;通过临床结果分析,ALKBH5的低表达与患者的低生存率显著相关。这些结果提示ALKBH5的下调可能与胰腺癌的发生发展有关。
❷ ALKBH5在转录组调控的基础上表现出抑癌活性
接下来,为了进一步探究ALKBH5在胰腺癌中的作用,作者在BxPC-3细胞中稳定过表达ALKBH5,然后进行转录组测序(BxPC-3/vector cells (Control) and BxPC-3/Lv-ALKBH5 cells (ALKBH5 overexpression)),RNA-Seq分析显示,与对照组细胞相比,在ALKBH5过表达的PC细胞中,共有367个差异表达基因 (204个上调基因,163个下调基因),其中显著上调的基因有PER1,FOXO1,CDC20,CCR5等。GO分析发现,细胞周期阻滞,抗增殖和凋亡等相关基因在ALKBH5过表达后特异性上调,而与细胞存活和增殖相关的基因显著下调。同时,KEGG通路分析显示,与细胞周期和生长密切相关的PI3K-AKT和P53信号通路显著激活。

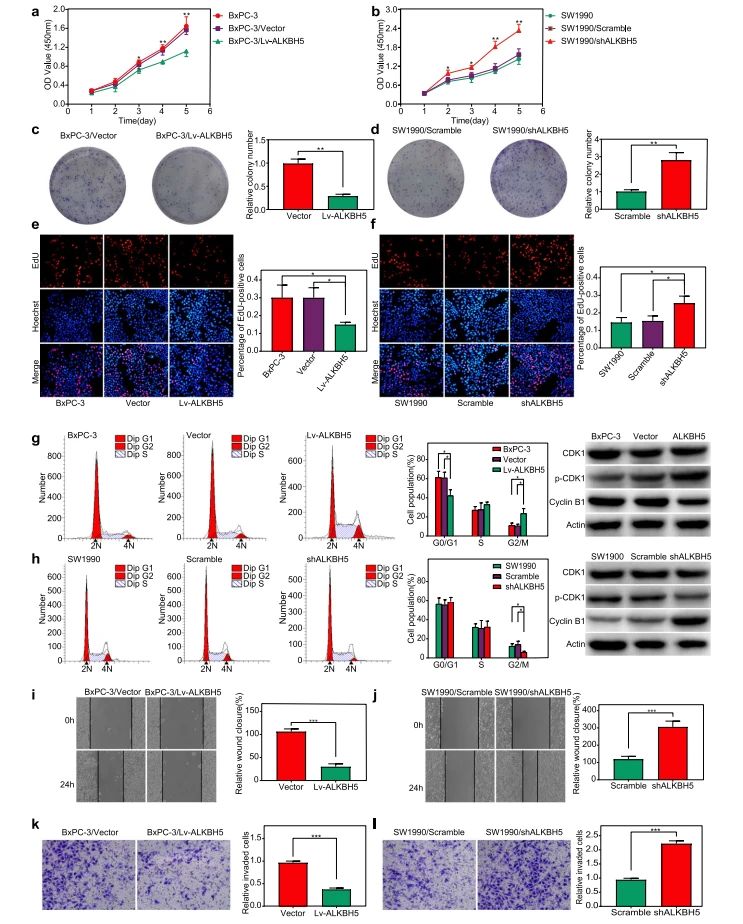
❸ ALKBH5抑制PC细胞的增殖、迁移和侵袭
接下来,作者进一步明确ALKBH5在胰腺癌中的作用。首先在胰腺癌细胞系中构建了ALKBH5敲降和过表达稳定细胞株,然后通过CCK8、克隆形成、EDU染色、流式等一系列实验证实过表达ALKBH5可以抑制胰腺癌细胞增殖;同时,划痕和Transwell实验显示过表达ALKBH5可以抑制胰腺癌细胞迁移和侵袭;与此相反,敲降ALKBH5会显著促进细胞增殖、迁移和侵袭。
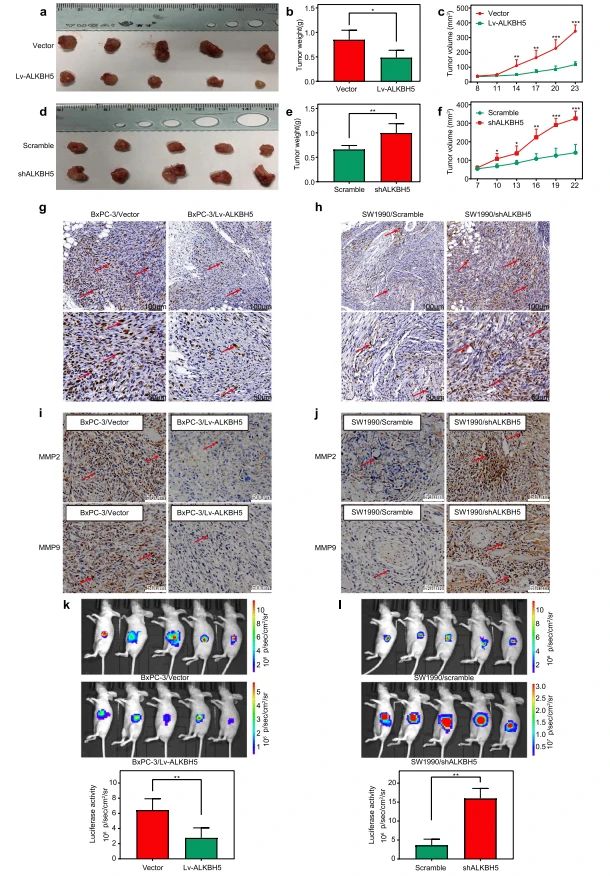
❹ ALKBH5抑制PC动物模型的肿瘤生长和转移
在细胞水平证实了ALKBH5的作用后,作者进一步在动物水平进行验证。通过构建ALKBH5敲降和过表达稳定细胞株、皮下异种移植、原位异种移植、稳定表达荧光素酶体内成像、免疫组化等实验,证明了ALKBH5抑制PC动物模型的肿瘤生长和转移,与细胞实验验证结果一致。
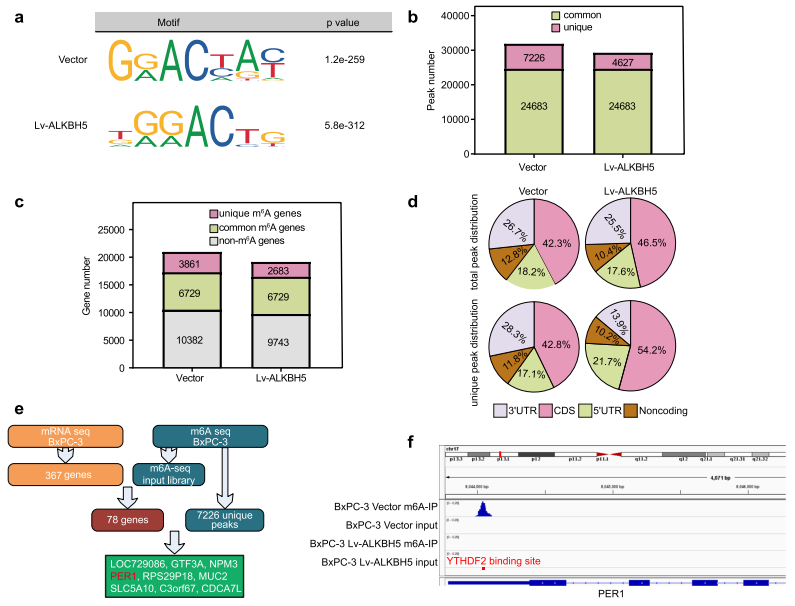
❺ ALKBH5通过靶向PER1调控PC
在体内体外实验中明确了ALKBH5的作用后,作者继续探究具体作用机制。首先通过RNA-Seq和m6A-Seq联合分析确定了PER1是ALKBH5下游靶标,并且,PER1 mRNA的m6A修饰位点上有m6A读取蛋白YTHDF2的结合位点。
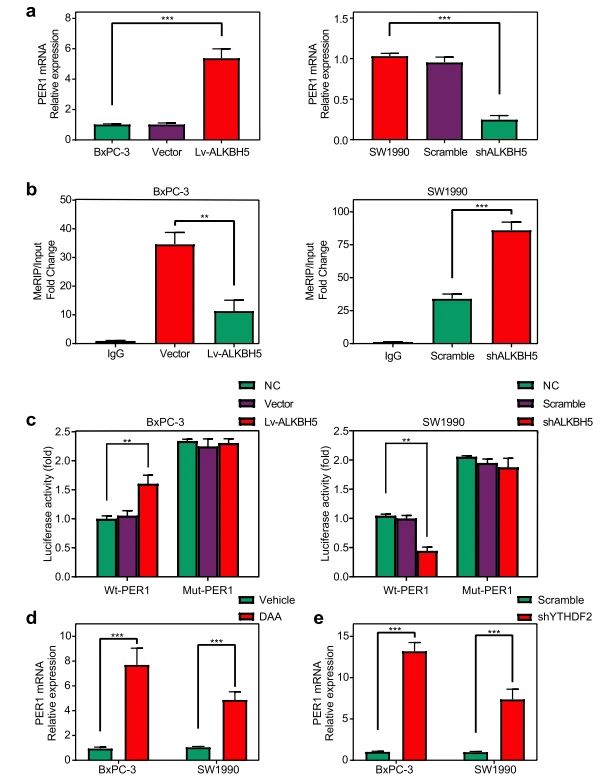
❻ ALKBH5以m6A-YTHDF2依赖的方式增加PER1 mRNA水平
随后,作者在ALKBH5敲降和过表达稳定细胞株中,通过qPCR、MeRIP-qPCR、荧光素酶等实验,证明了ALKBH5以m6A-YTHDF2依赖机制调控PER1的表达。
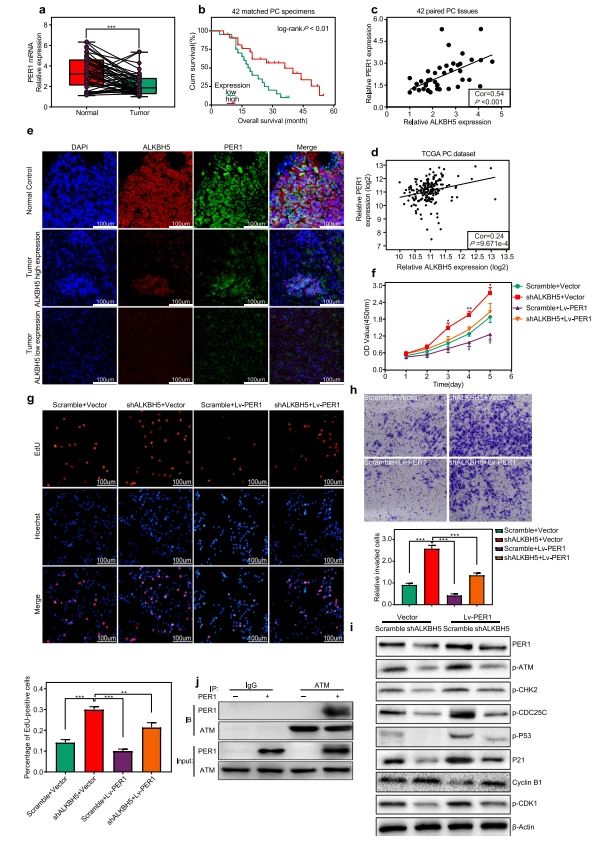
❼ ALKBH5在PC组织中与PER1表达相关,具有抑瘤作用
接着作者利用临床样本及TCGA数据集分析和免疫荧光验证说明PER1与临床胰腺癌患者的ALKBH5表达呈正相关。接着,作者通过 CCK-8、EdU and transwell 等回复实验,发现异位表达的PER1抑制了PC的进展,部分挽救了ALKBH5敲降导致的胰腺癌细胞增殖和侵袭的异常。最后,作者进一步发现异位表达的PER1水平可导致ATM依赖信号通路的激活,p-ATM、p-CHK2、p-CDC25C、pP53、P21和p-CDK1蛋白水平上调,并且免疫共沉淀实验证明了ATM和PER1具有相互作用。
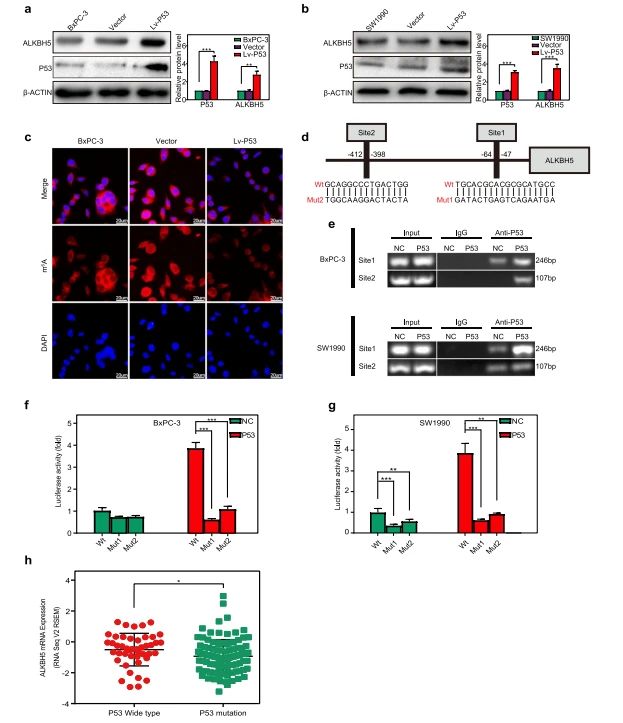
❽ PER1诱导的P53激活ALKBH5转录
以上实验其实就是一篇比较完整的文章了,但作者对机制实验进一步深入探究。研究发现,p53的异位表达,使得胰腺癌细胞ALKBH5水平显著升高;同时,免疫荧光染色显示P53的表达降低了BxPC-3细胞总RNA中m6A的水平。随后,通过Chip、荧光素酶等实验证实了,p53可以通过与ALKBH5的启动子结合激活其转录。最后,TCGA数据集分析还发现,p53野生组中ALKBH5水平较高,而p53突变组中ALKBH5水平较低。
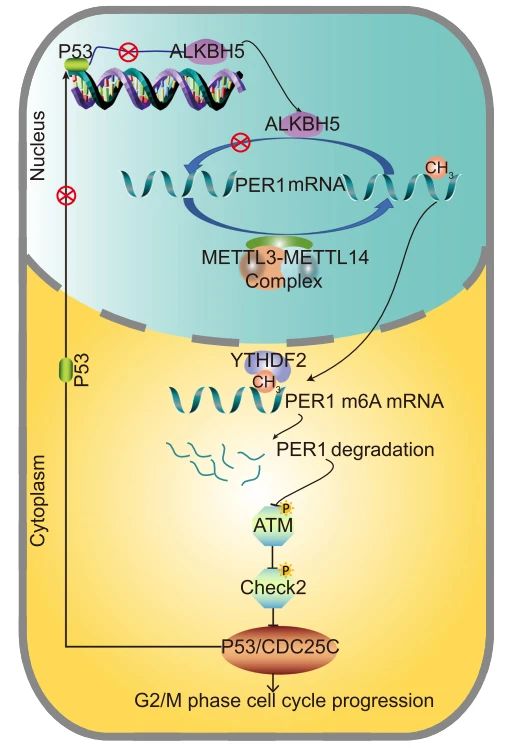
总结
ALKBH5缺失与胰腺癌临床病理特征差及预后不良有关。过表达ALKBH5可降低PC细胞的增殖、迁移、侵袭和肿瘤的生长,而ALKBH5敲降促进PC进程。PER1 mRNA的去甲基化及其水平的升高是ALKBH5以m6A-YTHDF2依赖的方式发挥作用。PER1诱导的p53上调和p53激活的ALKBH5转录可能反映了PC m6A修饰的反馈调控。

— 如有相关需要,欢迎扫码咨询 —


