 2021.06.15
2021.06.15  2168次
2168次
导言
今天小编分享一篇2021年4月9日发表于Cell的有关免疫治疗的文章——Glioblastomas acquire myeloid-affiliated transcriptional programs via epigenetic immunoediting to elicit immune evasion. 多形性胶质母细胞瘤(GBM)是一种侵袭性脑肿瘤,目前的免疫治疗方法尚未成功。在此,研究者探讨GBM中免疫逃避的新机制。通过将GBM干细胞(GSCs)连续移植到具有免疫活性的宿主中,获得具有逃避免疫清除的能力的GSC。从机制上讲,这不是通过肿瘤亚克隆的遗传选择引起的,而是通过表观遗传免疫编辑过程引起。在免疫攻击后,GSCs中的稳定转录和表观遗传变化得到加强。这些变化启动了骨髓细胞相关的转录程序,从而导致与肿瘤相关的巨噬细胞的募集增加。此外,在人间充质亚型GSCs中发现相似的表观遗传学和转录特征。全文结论:表观遗传免疫可能通过重塑肿瘤免疫微环境(TME),在最具侵袭性的间充质GBM亚型中驱动获得性免疫逃逸程序。
结论
➀ 免疫活性GBM小鼠模型中疾病相关TME的重现
➁ 免疫攻击后GSCs中转录组的稳定重组
➂ 免疫逃逸的GSCs部署“髓样拟态”以建立富集髓样的TME
➃ 获得性转录变化与表观遗传免疫编辑过程一致
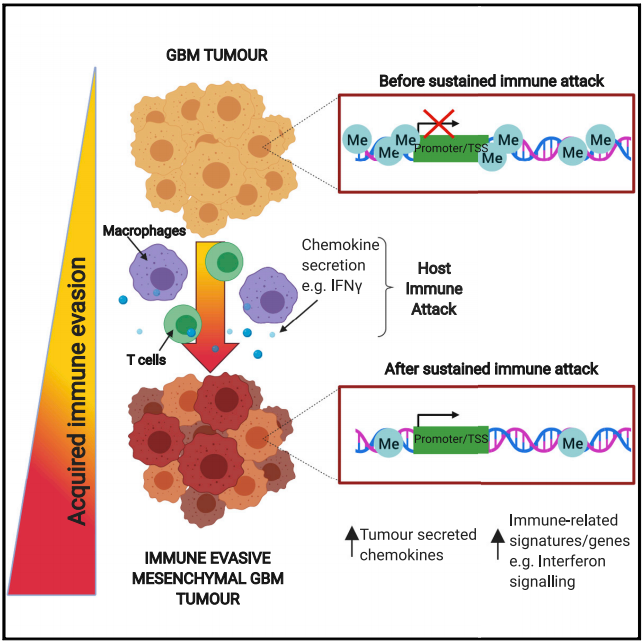
结果展示
工程化GSCs通过免疫活性宿主连续移植获得免疫逃逸能力
有研究表明,GBM由具有神经干细胞(NSC)特征的细胞驱动;基因工程小鼠模型和患者样品的基因组分析表明,内源性NSC可能是GBM的起源细胞。因此,研究者从C57BL/6 J(BL6)小鼠分离的NSC中构建了一组等基因GBM干细胞(GSCs),通过引入5种已确定的GBM驱动基因突变中的1种:EGFRvIII或PDGFRA过表达,CRISPR/Cas介导的Nf1、Pten或Trp53的敲除。这些单基因敲除的GSC表达典型的NSC标记物(NESTIN和SOX2),并保持分化为神经元和星形胶质细胞的能力。接下来,生成突变的组合以对间充质亚型进行建模。首先,通过共同敲除Nf1和Pten(NP细胞)制备了双突变型NSC。将GFP[+] NP细胞原位移植到免疫低下(NOD-scid-gamma [NSG])小鼠体内,导致形成小的良性生长。只有进一步用EGFRvIII过表达进行改造,形成三重突变细胞系(NPE)才观察到体内具有GBM预期特征的极具侵袭性的肿瘤生长和浸润。此外,还构建了一种与前神经元亚型相对应的肿瘤起始细胞系(PPP),其肿瘤侵袭性远不及NPE。
反向相蛋白阵列(RPPA)分析证实了突变NSCs中RTK和PI3K信号通路的激活,包括ERK、Ras、Raf、mTor、Akt和Src表达的升高。已知GBM的前神经亚型具有较低的免疫浸润和免疫抑制性TME,而NPE细胞更具攻击性,以及它们与免疫逃逸性最强的间充质GBM亚型的对应关系,研究者更专注于用NPE模型探索免疫逃逸机制。
实验证实,NPE细胞在具有免疫能力的同系BL6宿主中具有致瘤性,这使研究者能够对GBM细胞与免疫TME之间的相互作用进行建模。在免疫功能低下的NSG小鼠中形成的肿瘤作为对照相比发现,BL6小鼠中NPE肿瘤的出现速度比NSG小鼠中慢(分别为25-50天和15-20天),并且大多数BL6宿主可以长期存活。这些与BL6宿主免疫系统对NPE细胞的反应并限制其肿瘤形成是一致的。
研究者推断,通过从宿主进行系列移植后,从逃避免疫监视的BL6小鼠的肿瘤中获得原代GSCs培养物,可以富集具有获得性免疫逃逸能力的细胞。因此,从BL6小鼠的NPE肿瘤(NPE-BL6-TD)建立了新鲜的培养物。NPE-BL6-TD细胞被移植到第二级BL6宿主中,形成频率更高的肿瘤。然后,将从这些继发性肿瘤(NPE-IE)中重新获得的GSCs培养物移植到第三级BL6宿主中。移植了NPE-IE细胞的小鼠显示肿瘤形成增加,存活率明显低于先前移植的品系。但是,将NPE和NPE-IE细胞移植到对照NSG小鼠中时,显示出相似的致瘤性,并且没有发现NPE-IE细胞在体外具有增殖优势。总之,这些结果表明NPE-IE细胞具有免疫逃逸能力。

免疫逃逸型NPE-IE肿瘤具有高度免疫抑制的微环境
为了确认NPE-IE肿瘤是否由于逃逸T细胞清除能力而更具侵略性,研究者分别耗竭了NPE,NPE-BL6-TD和NPE-IE肿瘤的BL6小鼠中的CD8 T细胞群。在所有情况下都观察到肿瘤生长加快,肿瘤渗透率逐渐增加。这证实了NPE细胞系及其衍生物产生的肿瘤不会发生抗原丢失,而CD8 T细胞介导的清除正是它们主动逃逸的原因。
接下来,利用流式细胞术,比较了非肿瘤脑组织中与NPE或NPE-IE肿瘤脑组织中存在的免疫细胞类型。在荷瘤脑中,我们观察到总的脑免疫细胞储备发生了重大变化,包括巨噬细胞和CD8/CD4 T细胞(M1和M2样巨噬细胞的标志物)的显著增加,以及小胶质细胞的明显减少。此外,我们观察到荷瘤脑中的淋巴群显示出功能障碍的标志物,如PD-1和TIM3的表达。重要的是,肿瘤和邻近组织的荧光免疫组织化学表明主要的巨噬细胞群(F4/80[+] Iba1[+])局限于肿瘤块,并且在整个大脑中通常不增加。
直接分离肿瘤肿块以进一步表征肿瘤免疫微环境。多参数流式细胞仪数据显示NPE-IE肿瘤中的免疫细胞浸润较NPE肿瘤增加。重要的是,NPE-IE肿瘤中的单核细胞骨髓源性抑制细胞(M-MDSCs)和巨噬细胞显著增加,肿瘤浸润的巨噬细胞表达PD-L1的水平明显高于小胶质细胞。与NPE肿瘤相比,没有观察到NPE-IE肿瘤中巨噬细胞表型转换的证据;相反,在每种情况下,巨噬细胞表现出典型的吞噬和抗原呈现表型(即CD86[+]和CD11c[+]),以及免疫抑制标记物PD-L1。自然杀伤细胞(NK)和树突状细胞群没有明显变化。

阻断CSF-1R信号传导降低NPE-IE细胞的免疫逃逸能力
以往的研究表明巨噬细胞集落刺激因子1受体(CSF-1R)是治疗胶质瘤的一个潜在靶点。为了确定募集到NPE-IE肿瘤中的巨噬细胞是否支持免疫逃逸,在BL6小鼠中使用针对CSF-1R的靶向抗体耗竭这些细胞,这导致了肿瘤存活率的提高。在免疫功能不受影响的NSG移植对照中,该治疗无明显影响。因此,肿瘤相关巨噬细胞在维持BL6小鼠NPE-IE肿瘤的生长和免疫逃逸中起着关键作用。
虽然NPE-IE肿瘤中各种T细胞群的频率没有显著差异,但是发现PD-1和LAG3标记物阳性的CD8和CD4 T细胞群增加。这表明NPE-IE TME表现出T细胞功能障碍的升高状态和增强的免疫抑制功能。如前所述,两种肿瘤类型中的巨噬细胞对PD-1配体PD-L1的表达呈高度阳性,我们发现小胶质细胞对LAG3配体MHC-II的表达呈阳性,这表明除了TAM募集外,还存在其他免疫抑制途径。结果发现NPE来源的肿瘤可以逐渐逃避CD8 T细胞的清除,并建立一个越来越多的富含髓细胞和促肿瘤基因的TME,并伴随着T细胞衰竭。

免疫逃逸细胞在免疫攻击后发生显著的转录重组
为了揭示在NPE-IE细胞中观察到的获得性免疫逃逸机制,研究者对其基因组、转录组和表观基因组进行了表征。重要的是,NPE和NPE-IE细胞的核型分析和全基因组测序(WGS)在比较时均未发现明显的遗传破坏。这表明在NPE-IE肿瘤中观察到的获得性免疫逃逸特性并不是克隆进化或经典的遗传免疫编辑过程所能解释的。因此推测NPE-IE细胞可能已经获得了其他支持免疫逃逸的细胞内在的和稳定的基因表达变化。
研究者对一组细胞进行了mRNA-seq分析,包括单个突变系和来源于NSG肿瘤的细胞(无免疫攻击的体内微环境暴露的参考对照)。引人注意的是,在单个突变系中,Nf1缺失表现出最接近完全转化的NPE突变体的转录组。仅Nf1缺失富集与GBM相关的几个基因特征,包括显著激活血管生成和细胞迁移途径。这与间充质亚型中观察到的血管生成特征增加一致,表明Nf1的缺失可能是恶性转化的“原发”细胞。
然而,重要的是,免疫逃逸品系(NPE-BL6-TD和NPE-IE)获得明显不同的转录模式,这不能单独用Nf1缺失来解释,包括许多免疫相关基因。其中NPE-IE细胞中几种趋化因子的上调,特别是Ccl9,可解释NPE-IE肿瘤髓样细胞含量的增加。在免疫活性宿主细胞中上调的另一个有趣的候选基因是Irf8(干扰素调节因子8)。Irf8是一种髓样特异性的主转录因子,通常在造血细胞中专门表达,并且在髓样谱系和巨噬细胞分化中具有已知作用。Irf8在NSC中通常是沉默的,因此,在免疫攻击后,NPE细胞可能会不适当地“劫持”骨髓主调节转录因子的表达。总之,这些发现表明,体内免疫攻击显著触发了NPE细胞中的转录变化。

NPE-IE系中的免疫逃逸由表观遗传免疫编辑所支持
鉴于体内免疫攻击后诱导的转录变化在体外扩增后能稳定保留,研究者推断可能发生了表观遗传变化。利用亚硫酸氢盐还原代表性测序(RRBS)分析了全基因组DNA甲基化水平。主成分分析(PCA)显示了三个不同的组,并且在体内移植的细胞中发现了显著的低甲基化水平。NPE-BL6-TD和NPE-IE细胞系通过PCA紧密地聚集在一起,并且与NPE细胞相比表现出广泛的低甲基化水平。与mRNA-seq数据一致,免疫逃逸细胞中的许多差异去甲基化基因与免疫过程有关。
最重要的差异甲基化区域之一出现在Irf8启动子区和基因体中,甲基化在NPE-BL6-TD和NPE-IE系中逐渐消失,与转录激活增加一致。这些DNA甲基化模式的变化提示了“表观遗传学免疫编辑”过程。在该过程中,由免疫攻击引起的转录变化得以稳定,并被选择用于那些具有较高免疫逃逸能力的细胞中。这将导致高度免疫逃逸和转录改变的后代。有趣的是,研究者还发现其他免疫逃逸调节因子包括Nt5e(CD73)和Cd274(PDL1)都存在甲基化丢失,这与这些基因在体内被重新激活有关。
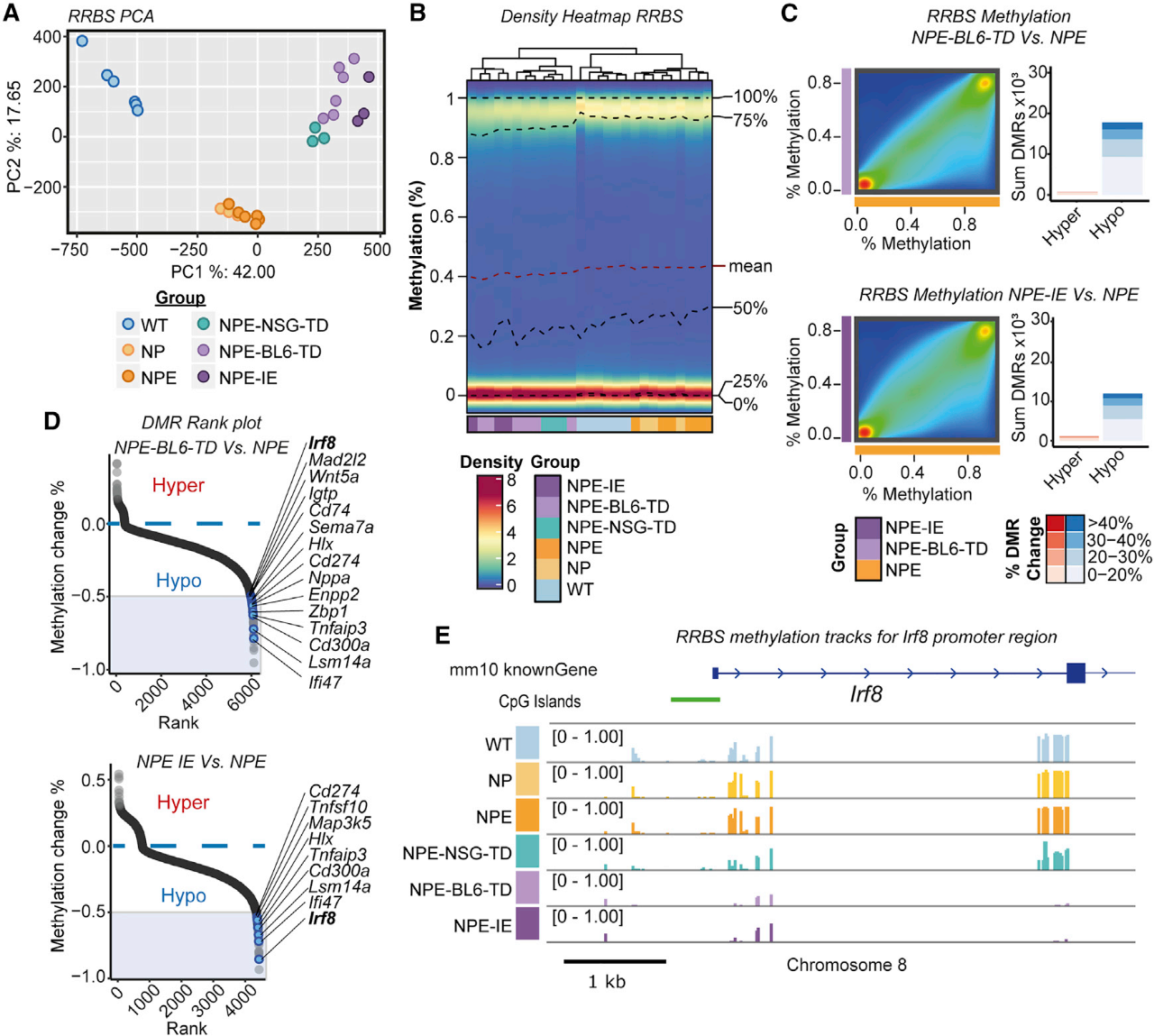
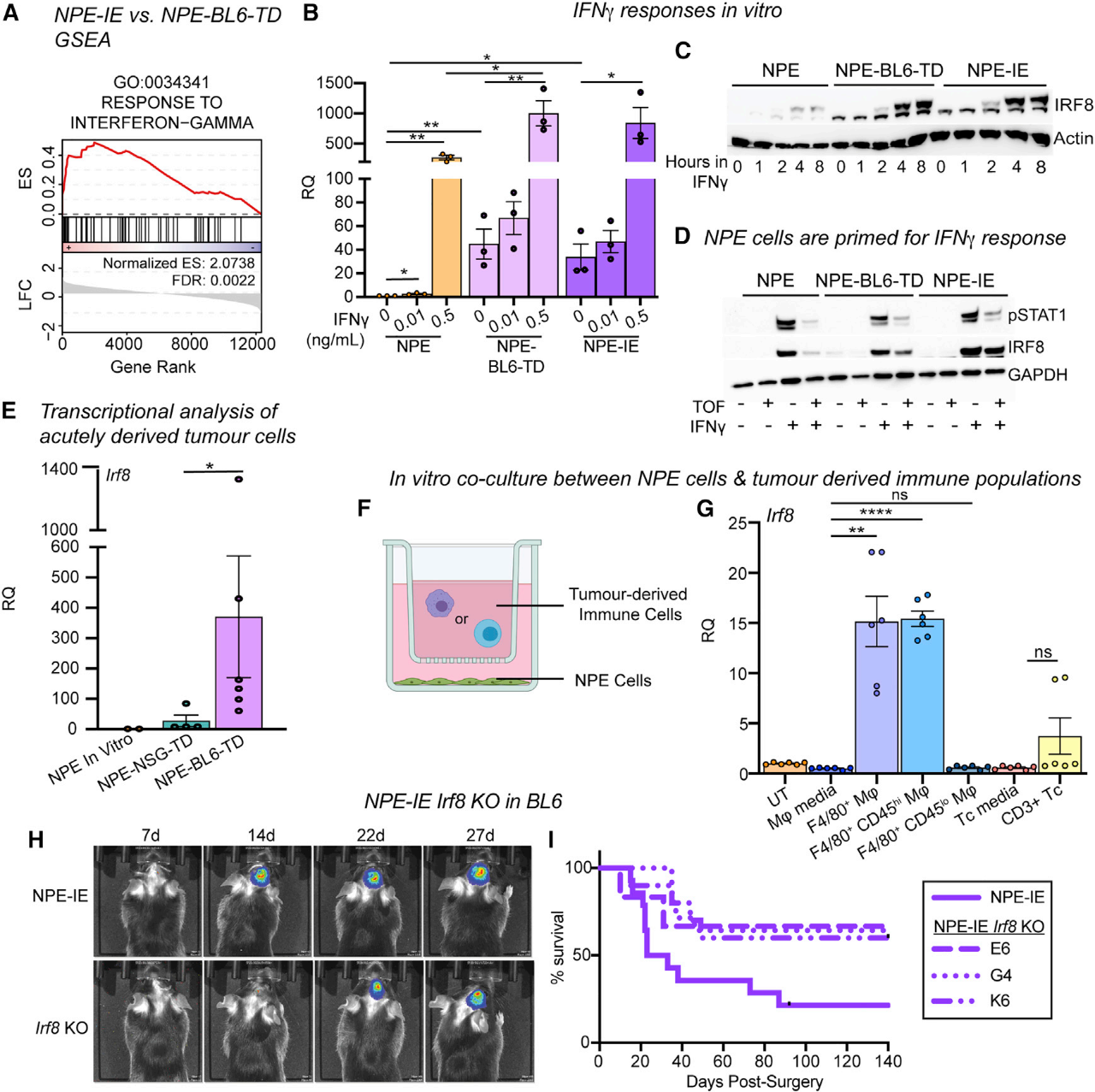
Irf8对NPE细胞中IFN-γ和TAMs有重要作用
有研究表明,Irf8通过IFN-γ诱导的STAT1信号在巨噬细胞中被激活。在NPE-IE细胞系中,对IFN-γ的反应是一个富集的状态,因此研究者假设来自免疫TME的慢性IFN-γ信号可能刺激NPE细胞中Irf8表达的激活。通过将免疫原性NPE细胞暴露于IFN-γ,直接在体外进行测试。实验发现,IFN-γ处理后,Irf8在NPE-BL6-TD或NPE-IE细胞中可以更快地达到更高水平。这与Irf8位点DNA甲基化缺失后快速转录激活的启动一致。在体外,未免疫的NPE细胞中I型IFN信号传导(通过IFN-α/β处理诱导)不能诱导与IFN-γ相同程度的Irf8表达。此外,JAK/STAT抑制剂托法替尼逆转了NPE细胞中Irf8的表达,但未能逆转NPE-IE细胞中Irf8的表达,这表明在NPE-IE细胞中存在JAK/STAT独立的机制,以维持Irf8的高表达。此外,直接分离的GFP[+] NPE-BL6-TD和NPE-NSG-TD肿瘤细胞的谱分析证实了关键基因的激活发生在体外扩增之前(例如Irf8,H2-Ab1)。因此,将NPE细胞暴露于具有免疫能力的体内环境足以诱导这些观察到的转录变化。
为了确定NPE-IE肿瘤TME内的免疫细胞类型,从NPE肿瘤中分离免疫细胞,并在体外与亲代NPE细胞共培养。数据显示,浸润性巨噬细胞群(F4/80[+],CD45[hi])可以刺激免疫原性NPE细胞中与NPE-BL6-TD和NPE-IE细胞中观察到的类似的转录变化。这表明浸润的巨噬细胞可能是体内信号的来源,例如IFN-γ可驱动这种反应。此外,尽管前神经PPP细胞在体内不能有效地生成肿瘤或显示免疫逃逸能力,但是研究者认为PPP细胞仍可能对NPE肿瘤源性免疫细胞共培养产生反应,因为在患者肿瘤中,前神经亚型可以转变为间充质细胞。
PPP细胞与从NPE肿瘤分离的免疫细胞的体外共培养表明,类似的转录程序可在神经模型中激活。接下来构建了NPE-IE Irf8敲除细胞系,这些表现出较低的攻击性表型,并且出现的肿瘤的动力学与未经免疫的NPE细胞移植的小鼠相似。综上表明,Irf8的激活是NPE-IE细胞免疫逃逸的重要因素,并且可能通过IFN-γ介导的体内激活而发生。
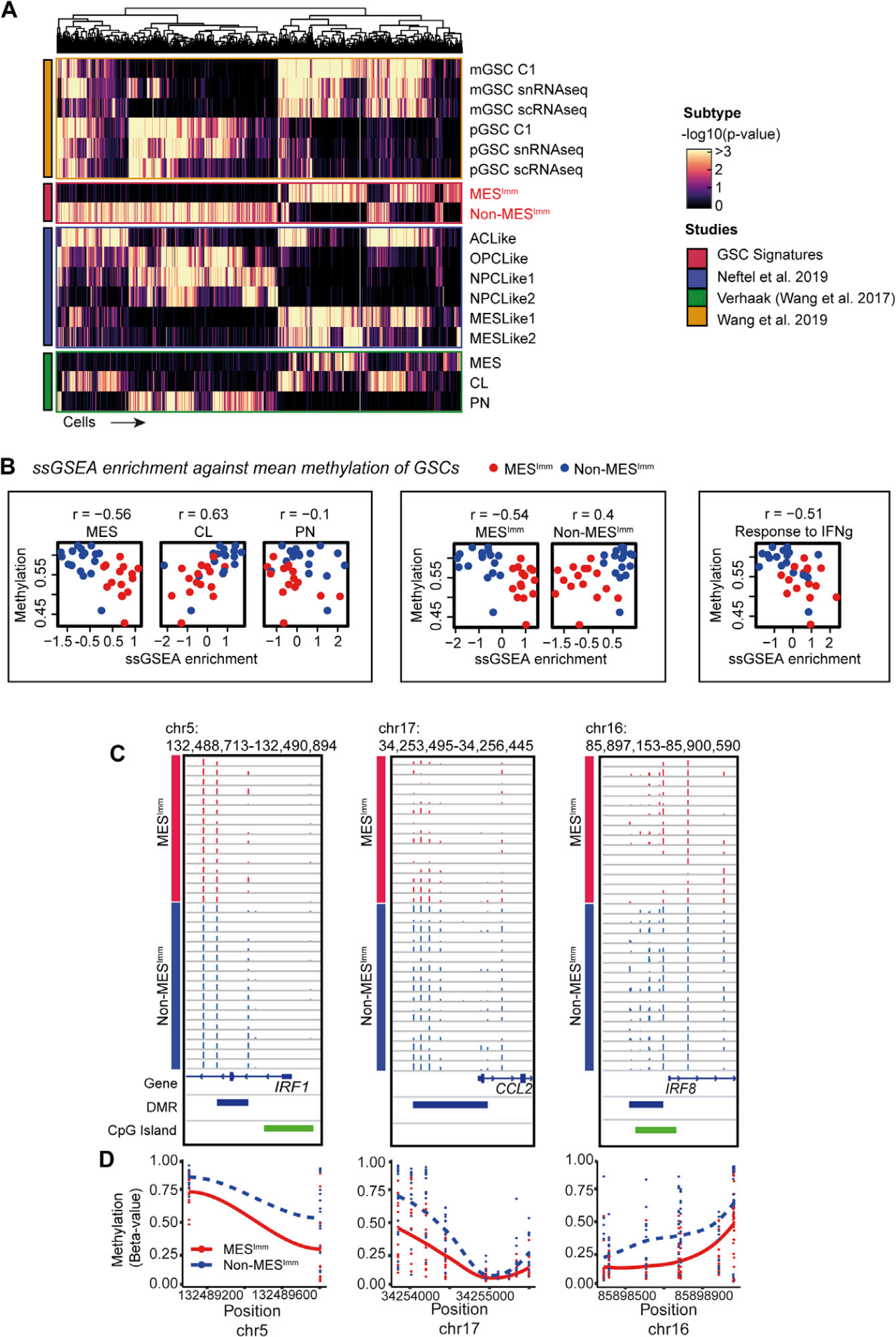
人GSCs有两种主要的转录亚型并且间充质GSCs由IFN信号传导决定
为了评估这些的发现是否与人类疾病相关,研究者对36种低传代患者来源的GSCs培养物进行了RNA-seq和分子亚型分析。通过分析体外扩增的GSCs,发现了两种不同的亚型:S1,称之为非间充质免疫标记(non-MES[Imm]);S2,称之为间充质免疫标记(MES[Imm])。这些元基因模块的富集与之前发表的基于全肿瘤转录本的标记性质相关。一个不同的转录谱与MES[Imm]亚型相关,包括与IFN信号相关显性特征。
值得注意的是,在富含MES[Imm]的GSCs中观察到几个干扰素调节因子家族成员的上调,包括Irf8和Irf7。但是,Irf1的关联更为明显。人Irf1也是一种IFN-γ反应性转录因子,据报道在髓样细胞的发育中与hIrf8一起发挥作用。此外,还发现MES[Imm]中CCL2的表达增加,这可能解释了间充质GBM中观察到的免疫种群增加。最后,证实了工程化NPE细胞中这种MES[Imm]的富集,随着细胞系获得免疫逃逸能力(即NPE-IE细胞)而增加。因此,在MES[Imm]人类GBM中也观察到了与小鼠模型中未发现的相关特征。重要的是,在没有IFN信号的情况下,这些转录特征在长期培养中是稳定且可遗传的。这与转录组稳定变化的表观遗传事件一致。通过将这些发现与独立的,可公开获得的单细胞RNA-seq(scRNA-seq)数据的分析进行比较,进一步验证了MES[Imm]和Non-MES[Imm]亚型。

人MES[Imm]-GBMs与NPE-IE细胞显示相似的DNA甲基化变化
为了评估富含MES[Imm]的人GBMs是否也能反映小鼠模型的DNA甲基化变化,在患者来源的GSCs中分析了DNA甲基化水平,结果观察到MES[Imm]亚型中DNA甲基化水平明显下降。此外,对来自患者GSCs的单样本基因集富集分析(ssGSEA)表明,在MES[Imm]亚型中观察到的低水平的DNA甲基化与先前发表的间充质标记相关,并且可能与相关免疫途径(如IFN-γ反应)的激活有关。值得注意的是,在MES[Imm]样品中,发现了与小鼠模型(包括Irf 1,CCL2和Irf 8)中确定的基因和途径相关的CpG岛上的甲基化缺失。这些人类GBM细胞的转录重组和表观遗传变化与小鼠模型中观察到的过程相似。因此,使用与在NPE-IE小鼠细胞中鉴定的机制相似的机制,人GBM还可进行表观遗传学免疫编辑,以稳定这种免疫逃逸状态。
总结
总体而言,研究者发现表明,GBM肿瘤中所观察到的亚型同一性的梯度或连续性可以通过肿瘤免疫微环境侵蚀其表观遗传环境和改变转录因子调控网络的程度来解释。转录和表观遗传重构以及髓系谱系特异性转录因子和转录模块的共同选择是在TME中发生免疫攻击后发生的肿瘤细胞内在反应。此外,探索巨噬细胞募集,保留和极化的相对作用,以及其他免疫细胞群的作用,需要进行更加深入的研究。尽管研究者对人类特征的分析与结论是一致的,但是还需要进一步直接测试免疫细胞或细胞因子对其转录状态的影响。将需要更深入的特征描述和测试(PPP)模型,以明确在此确定的途径对间充质亚型的特异性。



 返回列表
返回列表