 2020.05.06
2020.05.06  2087次
2087次

一、研究背景
乳腺癌仍然是全世界妇女面临的一个严重威胁。据估计,2018年乳腺癌新增病例超过210万,导致62.7万女性死亡。乳腺癌的死亡率主要是由于化疗耐受和转移。给予新的靶向干预可能有助于预防肿瘤发生或侵袭性转移,从而提高晚期乳腺肿瘤患者的生存率和临床预后。虽然乳腺癌的全球基因表达模式已被广泛研究,但涉及晚期乳腺肿瘤的基因表达的转录后调控尚未被充分研究。
目前已有100多种RNA修饰的报道,其中N6-methyladenosine (m6A)修饰,是真核mRNAs中最常见的内修饰。这种修饰的失调与人类疾病,包括恶性肿瘤密切相关。并且m6A的修饰是动态可逆的,在哺乳动物中,RNA既可以在甲基化转移酶(METTL3、METTL14、WTAP)的作用下发生m6A甲基化修饰,又可以在FTO、ALKBH5等酶的作用下发生去甲基化修饰。近年来,越来越多的研究结果表明,m6A是一种关键的转录后修饰,调控mRNA和非编码RNA的多种生物学过程,如调节前体mRNA的成熟、翻译和降解。
二、研究结果
❶ RNA去甲基化酶FTO,在人类乳腺癌中表达上调
作者首先分析了分析了111例乳腺肿瘤和12例非肿瘤性乳房组织的转录组学特征,发现与正常组织相比,FTO在乳腺肿瘤中显著上调;同时,在乳腺癌三个临床阶段的DNBC组(ER−/PR−/Her2+)和晚期组(二级和三级)中,也发现FTO的上调;随后作者进一步在乳腺癌细胞系和组织中验证了RNA m6A的水平,发现在乳腺癌细胞系和乳腺肿瘤中,m6A的丰度明显下降。通过临床结果分析,发现FTO的上调与晚期乳腺癌患者和ER阴性乳腺癌患者的低生存率显著相关。这些结果提示FTO的上调可能与乳腺癌的发生发展有关。
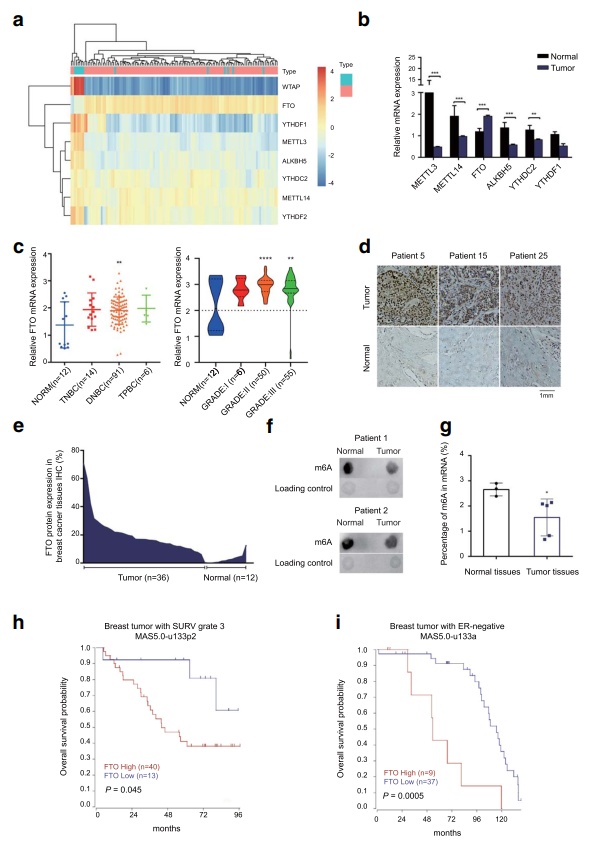
❷ FTO显著促进乳腺癌细胞增殖、集落形成,减少细胞凋亡
接下来,为了确定FTO是否对乳腺癌细胞生长至关重要,作者在MDA-MB-231和MCF-7细胞中稳定敲降FTO,随后进行了一系列细胞功能实验。结果发现,FTO敲降后,细胞增殖和集落形成能力被抑制,细胞凋亡水平上升;同时,Mammosphere formation assay结果发现敲降FTO后,乳腺癌细胞成球能力下降。
综上所述,研究结果表明FTO在控制乳腺癌细胞生长、集落形成和细胞死亡方面起着重要的作用。
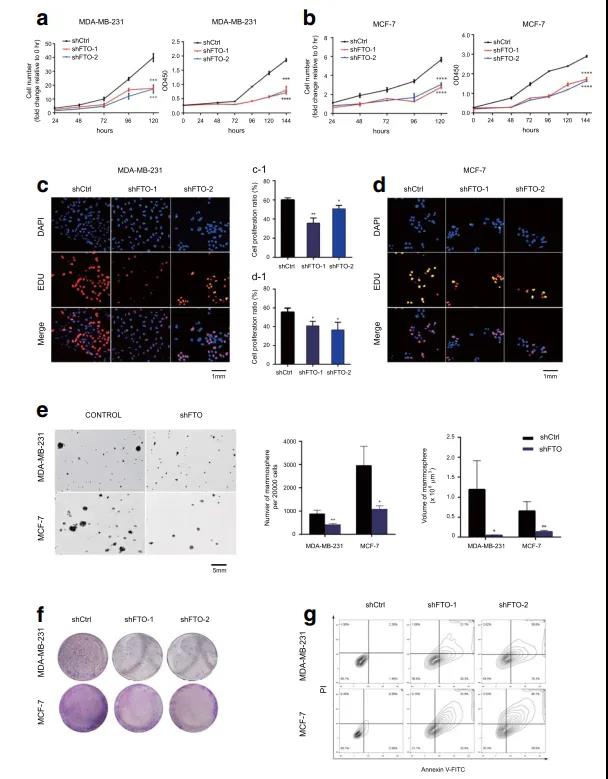
❸ 沉默FTO可抑制裸鼠乳腺肿瘤生长
接下来,作者进一步探究FTO在体内的作用。首先在4T1细胞(小鼠来源的乳腺癌细胞系)中构建了FTO敲降稳定细胞株,然后构建了皮下荷瘤模型。实验结果显示,FTO敲降的皮下肿瘤的生长明显受到抑制,同时,Rhein(FTO抑制剂)实验组小鼠也观察到肿瘤被抑制生长;随后,作者进一步在NOD/SCID小鼠中进行了原位异种移植实验,并且稳定表达荧光素酶用于活体成像,相比于对照组,FTO敲除组的小鼠几乎没有检测到肿瘤。
此外,通过尾静脉注射FTO敲降4T1细胞和对照细胞,建立肺转移瘤模型。结果显示,在FTO敲降组中,肺转移明显被抑制。以上结果表明FTO在体内促进乳腺肿瘤生长和转移中起着至关重要的作用。
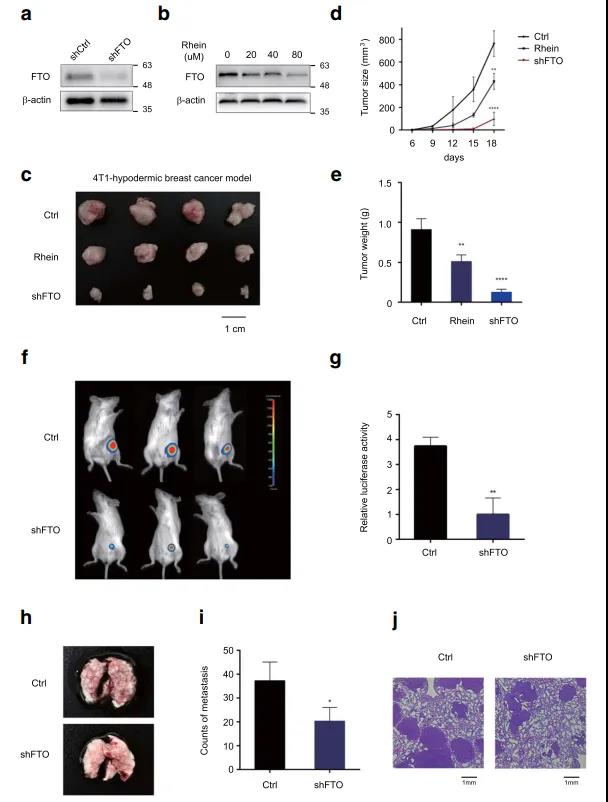
❹ RNA-Seq分析发现BNIP3是FTO介导的m6A修饰的下游靶点
为了探讨FTO的分子机制及其在乳腺癌中的下游靶点,作者用FTO敲降的细胞株MDA-MB-231和MCF-7细胞(FTO抑制剂DMOG处理)进行了转录组测序,GEO2R分析发现,在这两个样本中有55个具有显著变化的基因重叠;KEGG进一步分析显示,抑制FTO影响的差异表达基因显著富集在细胞增殖、细胞周期和凋亡信号通路。作者进一步采用m6A-Seq来绘制MDA-MB-231细胞中m6A修饰图谱,发现大多数m6A信号在mRNAs的终止密码子附近富集。随后,作者在其中选择FoxO信号通路中的促凋亡基因BNIP3作为FTO介导的m6A修饰的候选靶点进行下一步研究;BNIP3在FTO敲降和FTO抑制的细胞株中都显著上调,且string共表达分析表明,BNIP3与凋亡基因如Bcl-2和Caspase3密切相关。
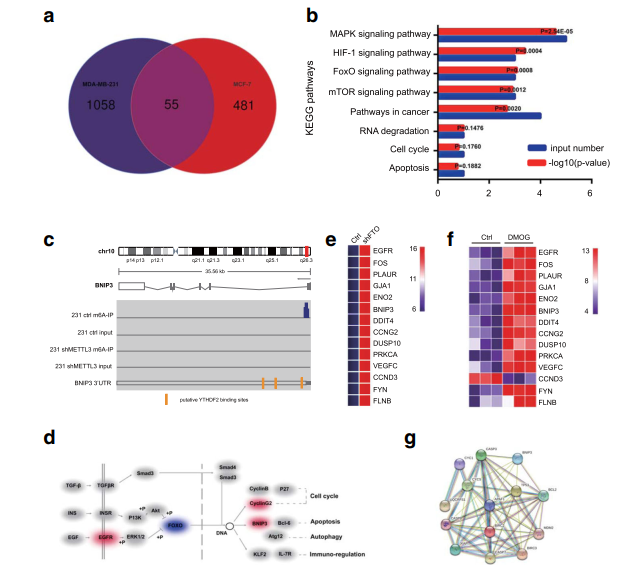
❺ FTO-m6A依赖机制对BNIP3的表观遗传学沉默
为了验证BNIP3是FTO的下游靶点,作者检测了乳腺癌细胞中BNIP3 mRNA的表达水平和蛋白的表达水平。与RNA-seq数据一致,BNIP3在FTO敲降细胞株MDA-MB-231和MCF-7细胞中显著上调,并且降低细胞中Bcl2的表达,促进了Caspase 3的裂解。这些结果表明,FTO通过下调BNIP3来抑制细胞凋亡。接下来,作者进一步确认BNIP3是FTO-m6A修饰的靶标,m6A MeRIP分析发现,敲降FTO显著提高了BNIP3基因的m6A水平。前面的m6A RNA-seq发现,在靠近BNIP3终止密码子的3′UTR中鉴定出3个潜在的m6A修饰位点,荧光素酶报告实验表明,位点#1是FTO对BNIP3 m6A调控的修饰位点。
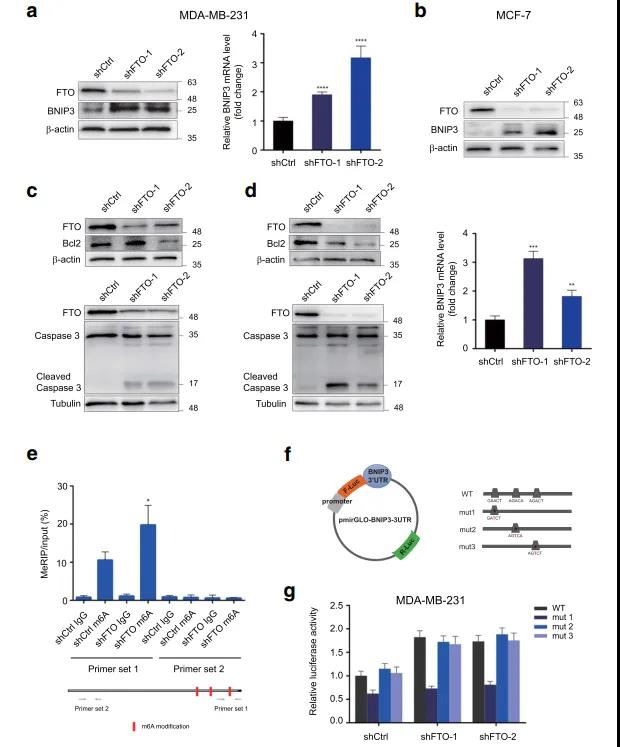
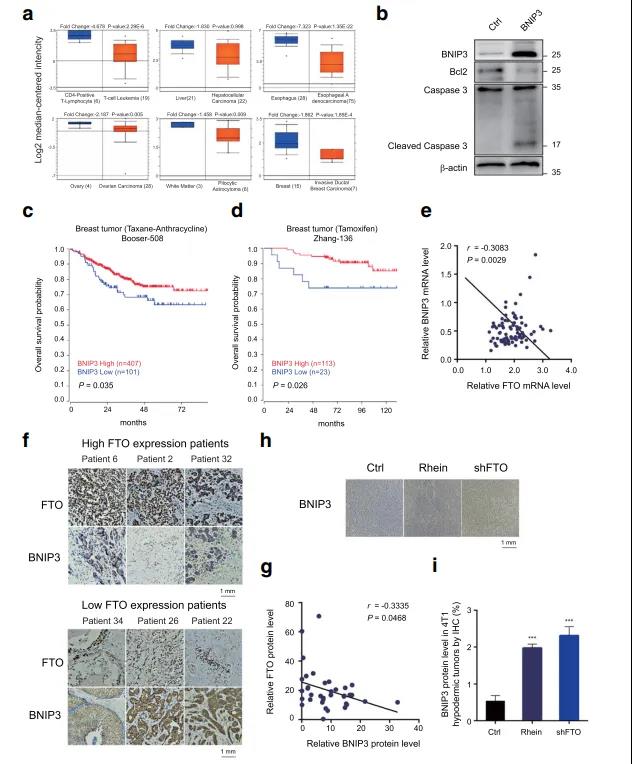
❻ BNIP3是一种肿瘤抑制因子,在临床乳腺癌患者中与FTO表达呈负相关
BNIP3作为FTO的功能靶点,是细胞凋亡所必需,提示其在乳腺癌中具有抑癌作用。通过对Oncomine数据库的分析,作者发现与非肿瘤附属组织相比,BNIP3在包括乳腺癌在内的各种人类癌症中下调,且过表达BNIP3激活了Caspase3的分裂,抑制了Bcl-2的表达。对R2数据集的分析发现,BNIP3的水平与使用紫杉烷-蒽环类药物和他莫昔芬治疗的乳腺癌患者的总生存率呈正相关。同时,通过数据库(GSE9014)分析和免疫组织化学实验,在乳腺肿瘤中观察到BNIP3和FTO的表达水平呈显著负相关。此外,在4T1皮下乳腺癌模型中,作责检测到BNIP3在FTO抑制或FTO沉默肿瘤样本中上调。结论:在临床样本中,BNIP3与FTO表达呈负相关。
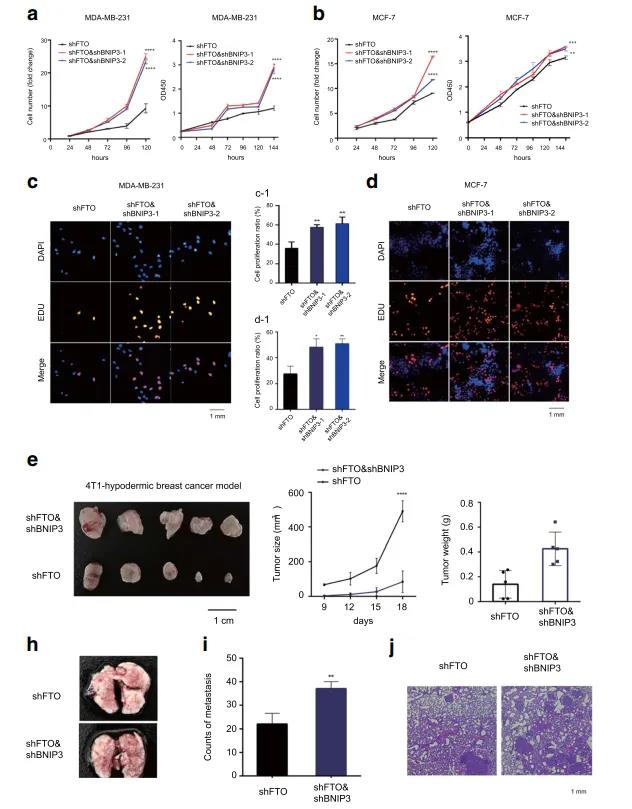
❼ 沉默BNIP3可显著减轻体外和体内依赖于FTO的肿瘤生长和转移抑制
为了探究BNIP3是否介导FTO依赖性肿瘤的生长和进展,作者在FTO稳定敲除乳腺癌细胞中转染靶向BNIP3的shRNAs,发现抑制BNIP3后减轻了由FTO介导的对细胞增殖的抑制作用,EDU实验进一步证明了这一结论。随后,为了验证BNIP3在体内的作用,作者将FTO-knockdown 4T1和双knockdown稳转细胞(shFTO和shBNIP3)皮下植入Balb/c小鼠,结果发现双重敲降(shFTO和shBNIP3)促进了小鼠乳腺肿瘤的生长。此外,在肺转移小鼠模型中发现,双敲除的4T1细胞的肺转移增加。结论:沉默BNIP3可以显著减轻FTO依赖的体内外肿瘤生长和转移抑制作用。
总结
m6A去甲基酶FTO在乳腺癌中的扮演着致癌角色。在FTO低表达细胞中,BNIP3 mRNA的3'UTR被m6A甲基化,BNIP3的表达上调诱导凋亡。而在FTO高表达细胞中,FTO介导BNIP3的m6A去甲基化,导致其表达下调,从而促进细胞增殖。因此,FTO-m6A-BNIP3信号通路可能成为乳腺癌治疗的潜在治疗靶标。



 返回列表
返回列表