 2021.01.08
2021.01.08  1984次
1984次
纽约基因中心和纽约大学等研究机构的研究人员们,利用CRISPR 筛选SARS-CoV-2的潜在治疗靶点,研究结果可能为开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。

BACKGROUND
新冠病毒(SARS-CoV-2)属于冠状病毒科,具有较强的传染性和低致死性。截止2020年10月,引起的新冠肺炎(COVID-19)病例数已达4000万,死亡人数超过100万。过去20年,已经出现了三个人兽共患的冠状病毒:SARS-CoV (2002) ,MERS-CoV (2012) ,SARS-CoV-2(2019)。鉴于SARS-CoV-2已经在全球范围内对人的生命和经济造成重大损失,许多研究机构、政府和药企已经致力于开发抗病毒药物和疫苗。目前,近30种抵抗SARS-CoV-2的疫苗已经进入临床实验中;美国食品与药品管理局(FDA)批准的瑞德西韦用于新冠肺炎治疗,作为SARS-CoV-2的RNA依赖RNA聚合酶抑制剂。目前新冠肺炎的治疗主要针对病毒本身,本研究提供了宿主基因如何影响病毒进入,并为治疗提供新的途径,有望加速易感人群的康复。
RESULTS
1、高通量筛选鉴定SARS-CoV-2感染必须基因
研究者使用人的GeCKOv2文库病毒(~0.2 MOI)感染A549ACE2细胞,嘌呤霉素药筛9天,随后0.3和0.01 MOI SARS-CoV-2分别感染巴细胞,感染24h检测核衣壳(N)蛋白表达,感染6天后存活的细胞被提取DNA用于高通量测序。研究者用3种方法(Robust rankaggregation,RIGER weighted-sum and second-best rank)鉴定的富集基因高度重叠。在低剂量和高剂量组的TOP 50中,有27个相同的基因。
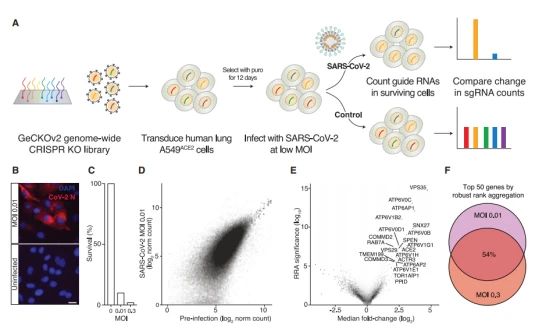
Fig1. 文库筛选寄NGS
2、富集基因参与病毒生命周期的多个方面且广泛表达
富集的基因分别参与病毒的吸附,内吞,纤突蛋白裂解和病毒膜融合,ER-Golgi运输,转录调控,聚集在少数蛋白复合物中,包括空泡ATP酶、逆转运复合体(Retromer)、Commander、Arp2/3和PI3K。
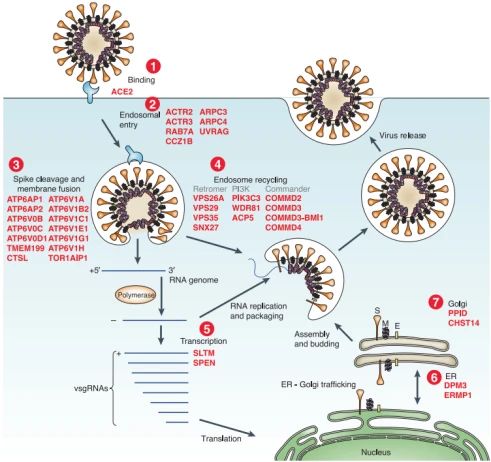
Fig2. Top-Ranked 基因参与病毒的生命周期
为了探索是否宿主基因丢失降低SARS-CoV-2 感染是肺组织特异性或者更广泛的表达,作者选取TOP Rank基因检测他们在12个组织中的表达,结果表明候选基因均在组织中广泛表达(Fig 3C)。
3、富集的基因参与病毒蛋白互作,也参与其他病毒的感染
Gordon et al. 分别表达带标签的SARS-CoV-2 蛋白,瞬转细胞后,pull down与宿主互作的蛋白,质谱鉴定出与病毒蛋白互作的332宿主蛋白。在CRISPR筛选中,部分排名靠前的蛋白也被报道与病毒蛋白互作(Fig 3D),如ATP6AP1 ,ATP6V1A 分别与nsp6,M蛋白互作。ATP6AP1在低MOI和高MOI组中分别排名第2和第4;RAB7A 与nsp7互作,文库筛选位于TOP 50。Samavarchi-Tehrani et al. 研究A549细胞中与SARS-CoV-2蛋白互作的宿主蛋白有22个与低MOI CRISPR 筛选的TOP 50一致。
有趣的是,SARS-CoV-2 和ZIKV感染的CRISPR细胞,筛选宿主基因在GO富集基因类别有更大的相似性。SARS-CoV-2 筛选的TOP 50基因中,若干宿主基因在流感病毒、ZIKV病毒感染中也显著富集,其中包含囊泡ATP酶质子泵(参与酸化和内体加工)。
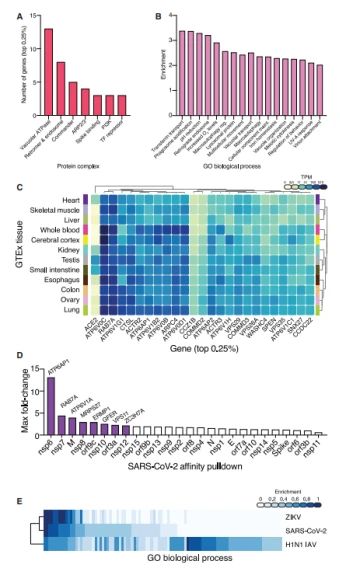
Fig3. 富集基因参与的信号通路、组织表达情况,与病毒蛋白互作,也参与其他病毒的发病机制
4、CRSPR Knockout,RNA干扰,小分子抑制剂验证富集基因
为了验证TOP-ranked基因阻断SARS-CoV-2病毒感染,研究者挑选30个基因,分别构建KO细胞株,随后用0.1 MOI SARS CoV-2感染细胞(Cas9-perturbed A549ACE2 ),感染36h,免疫荧光检测SARS CoV-2 N蛋白,结果表明每组感染的KO细胞降低了10倍。
囊泡转运基因如RAB7A, CCDC22, 和 VPS35,其他基因如 ACE2 ,CTSL 敲除后,显著降低了SARS CoV-2病毒感染、病毒载量。在人的肝细胞Huh7.5ACE2 也观察到类似的结果。siRNA 分别抑制靶基因,SARS-CoV-2 感染的细胞也显著下降。
CRISPR 筛选的TOP-ranked基因,结合药物-基因作用数据库(DGIdb数据库)筛选出69个制药基因,研究者筛选了9个基因,是26个小分子抑制剂的主要或次要靶点(Fig.4 E)。其中有9个药物是FDA批准的,7个是不同疾病的2期和3期临床实验。小分子抑制剂和瑞德西韦中,PIK-III, Compound-19, SAR405, autophinib, ALLN, tamoxifen, and ilomastat 显著抑制了病毒的感染,病毒载量降低100倍;靶向PIK3C3 的4个抑制剂、autophinib和ALLN 组病毒载量降低1000倍。
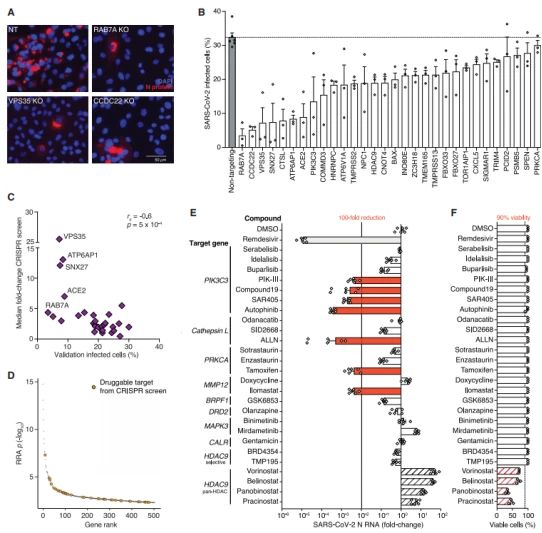
Fig. 4 单基因验证及药物靶标筛选
5、单细胞测序鉴定胆固醇合成作为多个富集基因的调控机制
为了更好的理解每个基因KO后如何影响SARS-CoV-2感染和宿主基因缺失改变转录进程,研究者利用ECCITE-seq鉴定分子机制和抵抗病毒感染的细胞通路;研究者发现ATP6AP1, ATP6V1A,CCDC22, NPC1, PIK3C3,和RAB7A基因Knockout,产生相似的上调差异表达基因,并且导致脂质和胆固醇生物合成途径上调,这6个基因的功能缺失突变可能通过类似的机制发挥作用,即抵抗病毒介导的胆固醇合成机制。差异表达的基因中,有61个和CRISPR 筛选重叠,如在6个靶基因Knockout细胞中,胆固醇表达量显著上调。利用这一见解,作者研究了氨氯地平(amlodipine)的影响,氨氯地平处理的细胞中,病毒感染细胞数、核衣壳mRNA,噬斑形成显著降低;amlodipine处理细胞的RNA-seq显示的差异表达基因和ECCITE-seq相似,其中胆固醇生物合成途径上调。
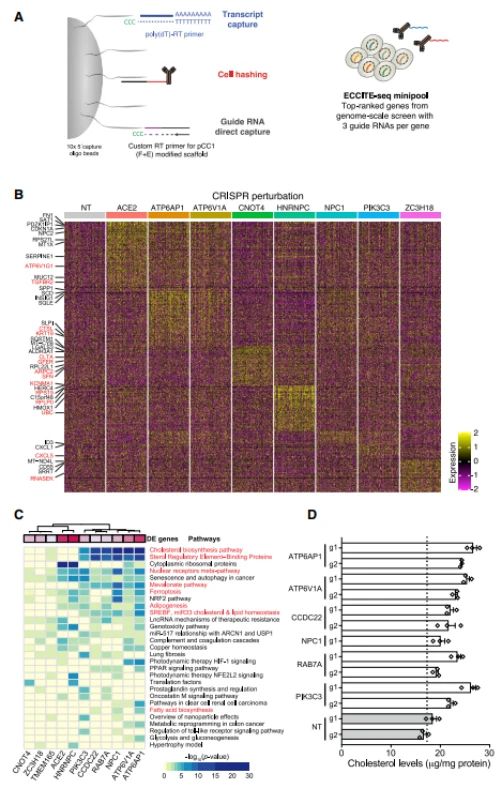
Fig.5 单细胞转录组
6、RAB7A Knockout降低细胞表面表达ACE2, 增加内体累积ACE2
Rab7a 是一个小的GTP酶,调控囊泡运输和膜转运。RAB7A Knockout细胞表面ACE2表达显著降低。共聚焦观察发现,RAB7A Knockout导致ACE2累积在胞浆和内体,少部分位于溶酶体。
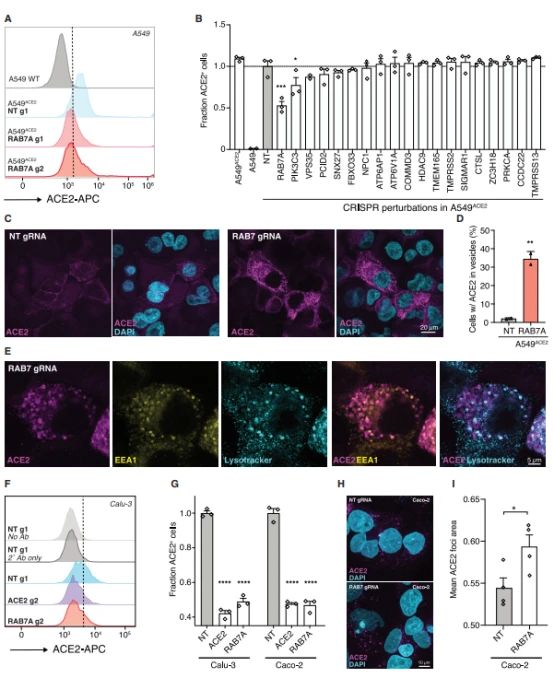
Fig.6 RAB7A Knockout降低细胞表面表达ACE2, 增加内体累积ACE2
综上所述,该研究可能为开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点,有望加速易感人群的康复。
参考文献:
1.Zharko Daniloski et al. Identification of required host factors for SARS-CoV-2 infection in human cells. Cell, 2020, doi:10.1016/j.cell.2020.10.030.



 返回列表
返回列表