 2020.04.07
2020.04.07  2189次
2189次

小细胞肺癌(SCLC)占肺癌的15-20%,由于其早期即可发生广泛转移,被公认是肺癌中分化程度最低、恶性程度最高的一种亚型。这也是SCLC患者预后差、死亡率高的主要原因。因此,揭示SCLC转移的分子机制是当前国际肺癌研究领域的热点之一。来自中国科学院生物化学与细胞生物学研究所的季红斌与高大明研究组合作在The Journal of Clinical Investigation杂志上发表文章,报道发现CUL5/SOCS3复合物在SCLC转移中的重要调控作用,并提示靶向SRC可作为治疗CUL5缺失的SCLC的潜在策略。
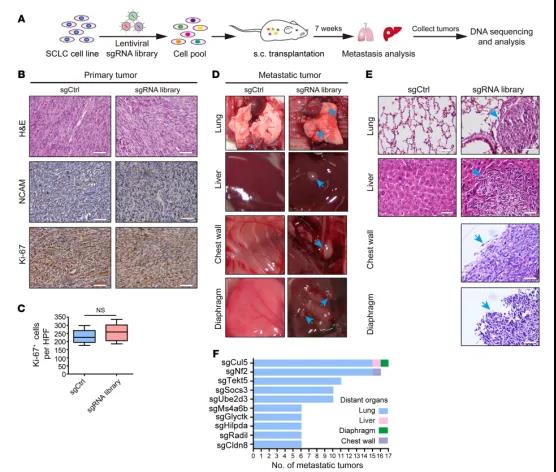
图1体内genome-scale CRISPR/Cas9筛选SCLC转移抑制基因
使用CRISPR/Cas9全基因组文库结合 Rb1fl/fl Trp53fl/fl SCLC鼠自发转移模型(Rb1fl/fl Trp53fl/fl 是SCLC临床上常见的2个突变失活基因)筛选SCLC转移相关基因。皮下接种文库细胞7weeks,sgCtrl对照组无器官转移,sgRNA library组转移器官有肺、肝、胸壁、隔膜,取461个肿瘤用于高通量测序,筛选出142个候选基因可能参与SCLC转移,其中Cullin-Ring E3泛素连接酶复合物的两个组分CUL5和SOCS3都排名靠前,提示可能是抑制SCLC转移的候选基因。
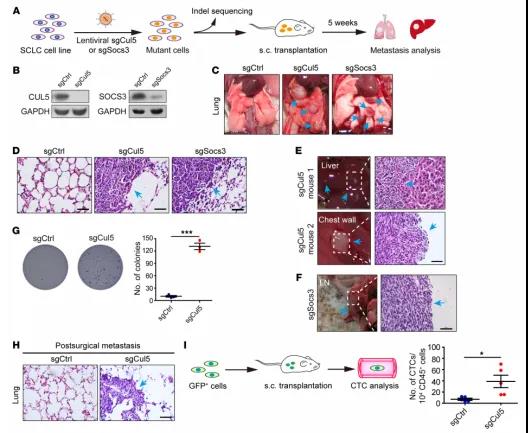
图2 Cul5缺失增强小鼠SCLC转移
众所周知的是,Cullin-Ring E3泛素连接酶复合物的两个组分CUL5和SOCS3通过Elongin BC连接从而促进底物降解。因此,后续选择CUL5/SOCS3继续研究。研究表明,CUL5敲除后转移器官有肺(5/5)、肝(1/5),胸壁(1/5),SOCS3敲除后转移器官有肺(5/5)、淋巴(1/5),对照组均无转移;值得注意的是,体内成瘤、软琼脂、术后转移小鼠、循环肿瘤细胞检测结果显示,敲除CUL5/SOCS3可显著增强SCLC的增殖和转移能力。
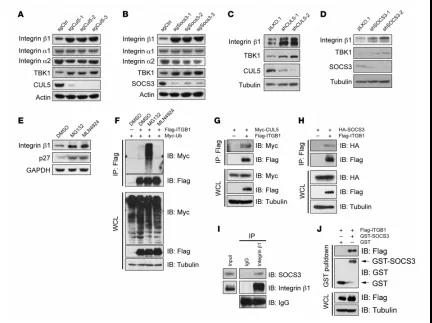
图3 CUL和SOCS3缺失导致整合素β1累计
整合素β1是SCLC中β型整合素的主要类型,通过感知胞外基质的信号来调控SCLC的转移。我们推测Cullin-Ring E3泛素连接酶复合物可能调控整合素的表达。机制分析发现,CUL5/SOCS3的缺失会破坏E3连接酶复合物的形成,导致整合素β1蛋白表达累积。COIP、GST-pulldown结果表明,整合素β1是CUL5-SOCS3复合物的降解底物。
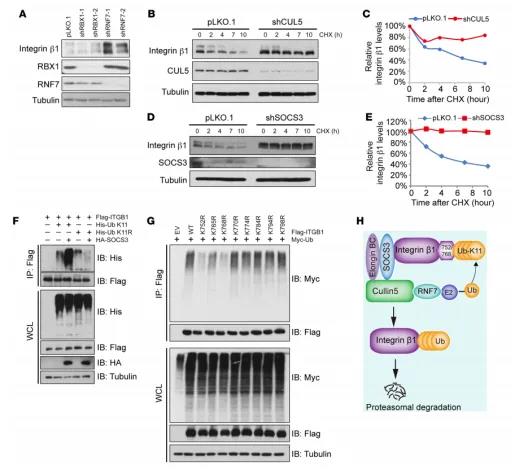
图4 CUL5-SOCS3 E3泛素化链接酶复合物促进整合素β1泛素化、降解
蛋白质的泛素连接由E3泛素连接酶催化,该酶是Cullin-RING复合体超级家族的最佳代表。Cullin-Ring Ligase(CRL)中CRL5依赖RNF7泛素化降解底物,RNF7缺失导致整合素β1累积,提示CUL5、SOCS3、RNF7是E3连接酶降解整合素β1的主要成分。
K48,K63,K11位多聚泛素化修饰是蛋白酶降解底物的经典信号,研究报道CRL5 E3连接酶通过K11位多聚泛素化修饰来降解底物。我们的研究也表明CUL5-SOCS3连接酶复合物促进整合素β1的K11位多聚泛素化修饰。
为了进一步鉴定整合素β1胞质尾区的特异性赖氨酸残基与泛素化链的共价结合,我们通过精氨酸残基取代赖氨酸残基,获得一系列的整合素β1突变体,并检测这些突变体对CUL5-SOCS3复合物介导的泛素化和降解应答。研究表明,整合素β1-K752R和K768R位点突变更有效抑制SOCS3介导的蛋白降解和较少的泛素化。
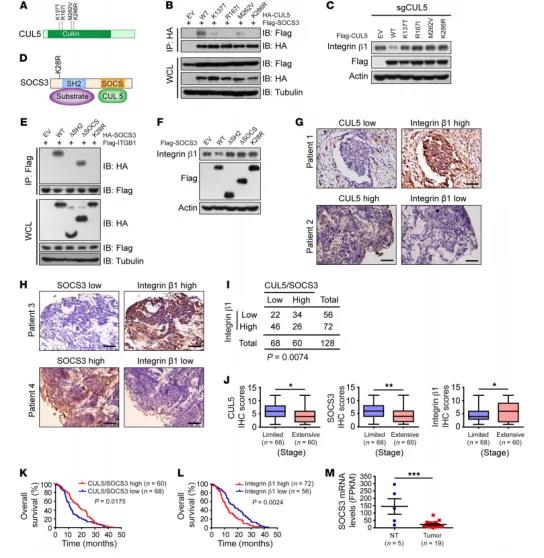
图5 CUI5和SOCS3缺失通过影响整合素β1促进SCLC进程
CUL5突变(K137T,R167I,M262V,K286R)减弱了CUL5和SOCS3的相互作用,导致整合素β1表达量增高;在CUL5缺失细胞中过量表达CUL5,整合素β1表达量降低;与底物相互作用的SOCS3 SH2缺失一致,SOCS3 K28R突变体不能与整合素β1相互作用,促进其降解。在SCLC中,CUL5和 SOCS3突变会使CUL5-SOCS3E3复合物失活,并且不能促进底物降解。另外,临床数据分析表明,肿瘤组织中CUL5/SOCS3低表达的小细胞肺癌患者往往伴随整合素β1高表达,并且患者预后较差。
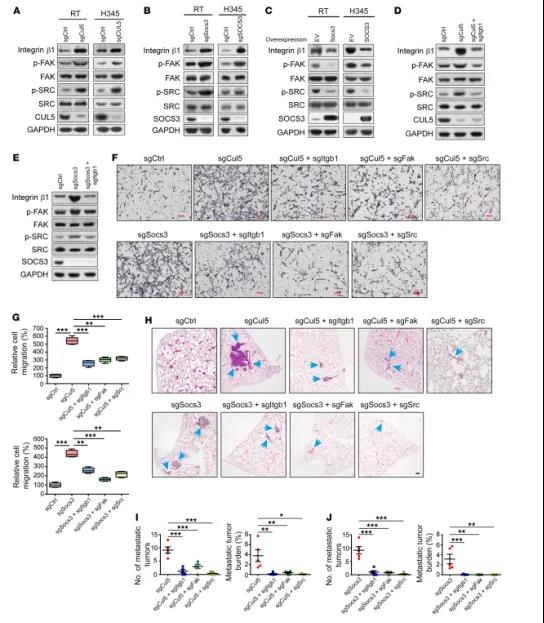
图6 CUL5-SOCS3复合物通过整合素β1/FAK/SRC信号通路抑制SCLC和转移
研究人员发现,CUL5/SOCS3缺失所导致的整合素β1累积主要通过激活其下游的FAK/SRC信号通路,最终促进了小细胞肺癌的转移。
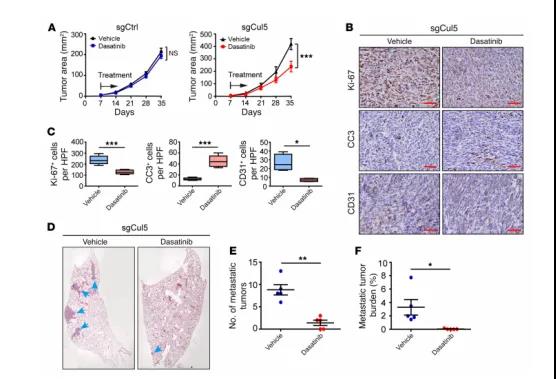
图7 达沙替尼治疗对CUL5缺失小鼠肿瘤生长和转移的影响
有研究表明,SRC在恶性肿瘤中扮演重要作用。考虑到SRC缺失可能有效抑制CUL5缺陷性SCLC转移。利用临床前动物模型进一步发现,FDA批准的SRC抑制剂达沙替尼灌胃SCLC模型小鼠,确实能有效地抑制CUL5缺失的小鼠SCLC恶性进展。
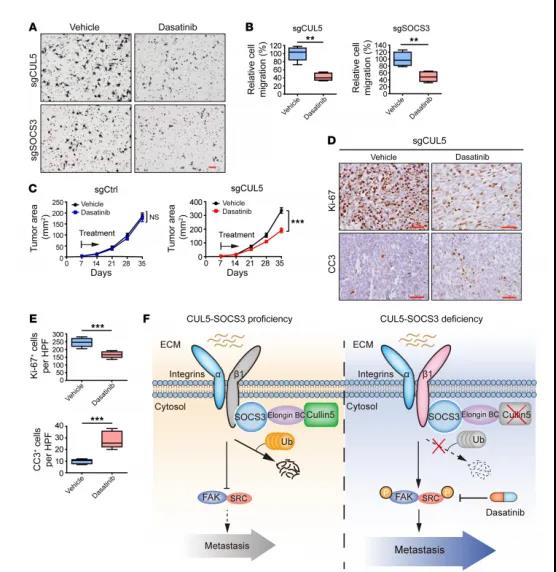
图8 达沙替尼对CUL5缺失的SCLC模型的影响
接下来,我们检测达沙替尼在人SCLC模型中的效果。在多个人SCLC细胞模型中分别敲除CUL5和SOCS3,体外研究表明,CUL5和SOCS3敲除对达沙替尼的敏感性没有影响,但是显著抑制了迁移。体内移植瘤结果表明,达沙替尼通过抑制增殖,促进凋亡介导CUL5敲除异种移植肿瘤的生长。
总的来说,该研究揭示了CUL5/SOCS3复合物在小细胞肺癌转移中的重要调控作用,并提示靶向SRC可作为治疗CUL5缺失的小细胞肺癌的潜在策略。



 返回列表
返回列表