 2020.03.06
2020.03.06  1833次
1833次
一、研究背景
结直肠癌(CRC)是世界上第三常见的癌症和第四致命的恶性肿瘤。虽然在过去的几十年里,手术联合系统治疗已经改善了CRC患者的预后,但肿瘤复发和肝转移在CRC患者中仍然很常见,且与较差的生存率密切相关。因此,更好地理解CRC启动和进展的机制是至关重要的。
目前已有100多种RNA修饰的报道,其中4-6种为n6 -甲基ladenosine (m6A)修饰,是真核mRNAs中最常见的内修饰。这种修饰的失调与人类疾病,包括恶性肿瘤密切相关。在哺乳动物中,RNA既可以在甲基化转移酶(METTL3、METTL14、WTAP)的作用下发生m6A甲基化修饰,又可以在FTO、ALKBH5等酶的作用下发生去甲基化修饰。近年来,越来越多的研究结果表明,m6A是一种关键的转录后修饰,调控mRNA和非编码RNA的生物学过程。
据报道[2],METTL3的缺失降低了DGCR8与初级microRNAs (primiRNAs)的结合,并导致成熟microRNAs的减少。同时,有研究发现METTL14与DGCR8相互作用,并以一种依赖于m6a的方式正向调控初始miR-126 (primiR-126)成熟过程[3]。
二、研究结果
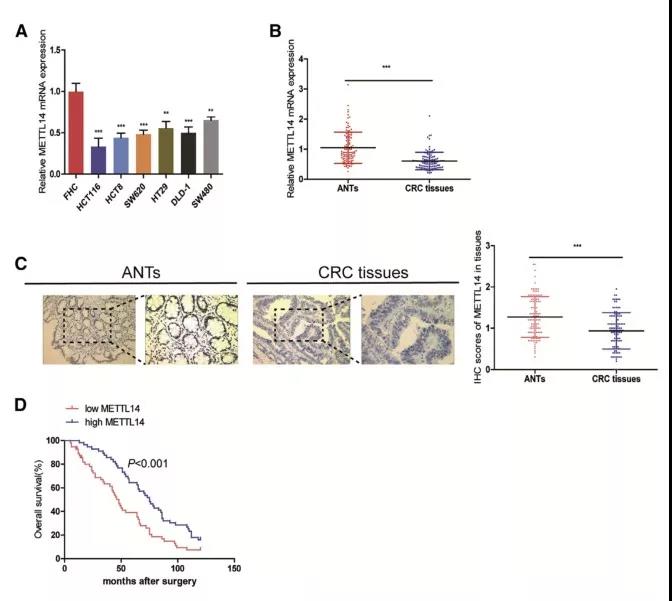
1、METTL14在CRC组织和细胞系中下调,且与患者总生存率相关
作者首先检测了CRC组织和细胞系中METTL14的表达情况,结果发现,与FHC(正常结肠上皮细胞)相比,在CRC细胞中检测到较低水平的METTL14;与此类似,检测112对CRC组织和ANTs(癌旁组织),发现CRC组织中METTL14的水平低于ANTs;同时,METTL14的表达下降与CRC进展相关。
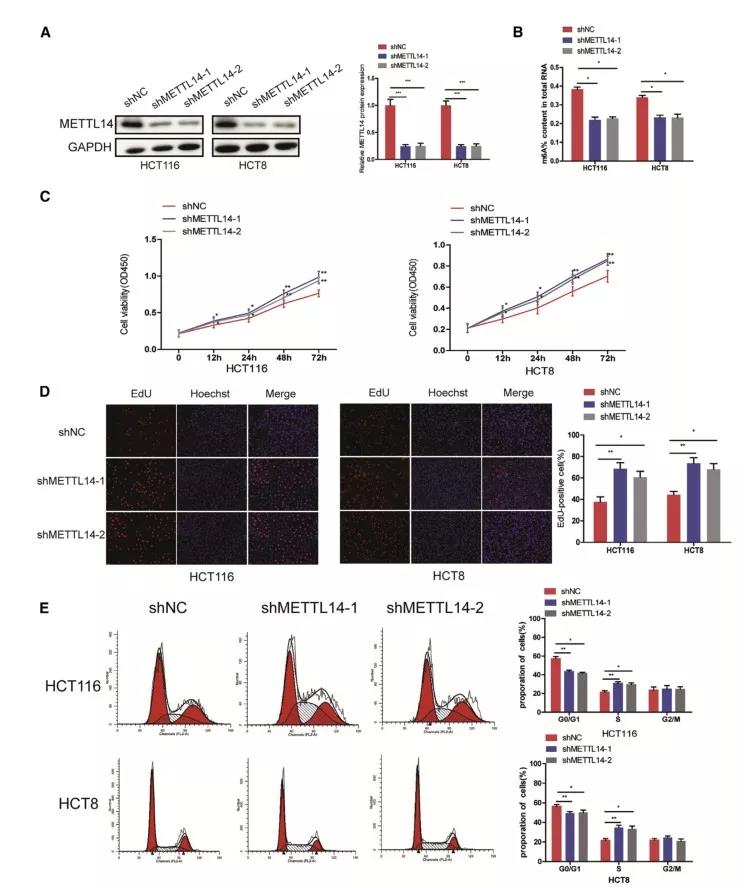
2、METTL14抑制CRC细胞增殖、迁移和侵袭
接下来,为了探究m6A修饰对CRC发生和发展的影响,作者在HCT116 和 HCT8 细胞中敲降METTL14,随后检测细胞整体m6A水平和细胞活力。结果发现,敲降METTL14后,两株细胞m6A水平下降,细胞增殖活性显著上升;同时,检测细胞周期,结果发现敲降METTL14后,细胞S期比列显著增加。
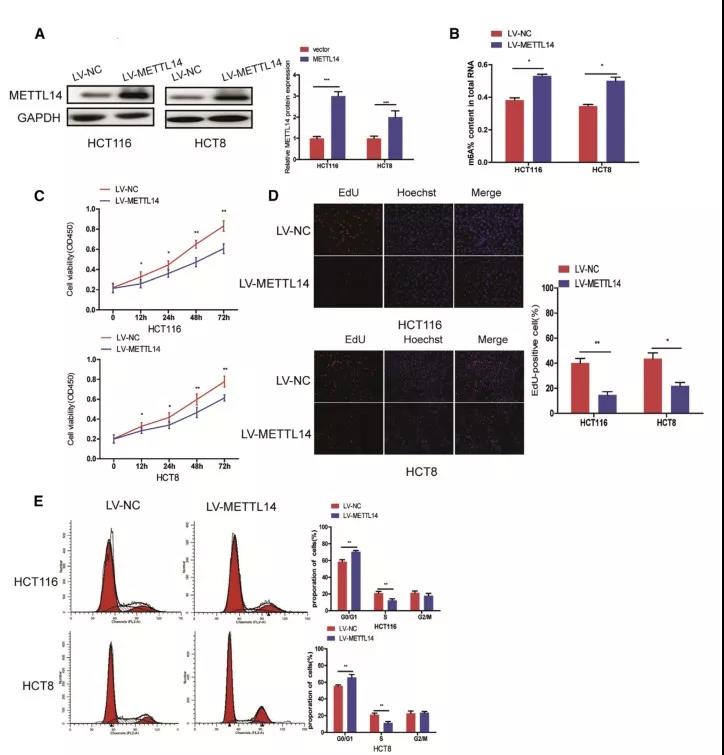
为了进一步确认METTL14对CRC细胞增殖的影响,作者同时在HCT116 和 HCT8 细胞中过表达METTL14,实验结果显示,过表达METTL14后,细胞m6A水平上升,细胞增殖被抑制,G0/G1期细胞数增多,S期细胞数下降。
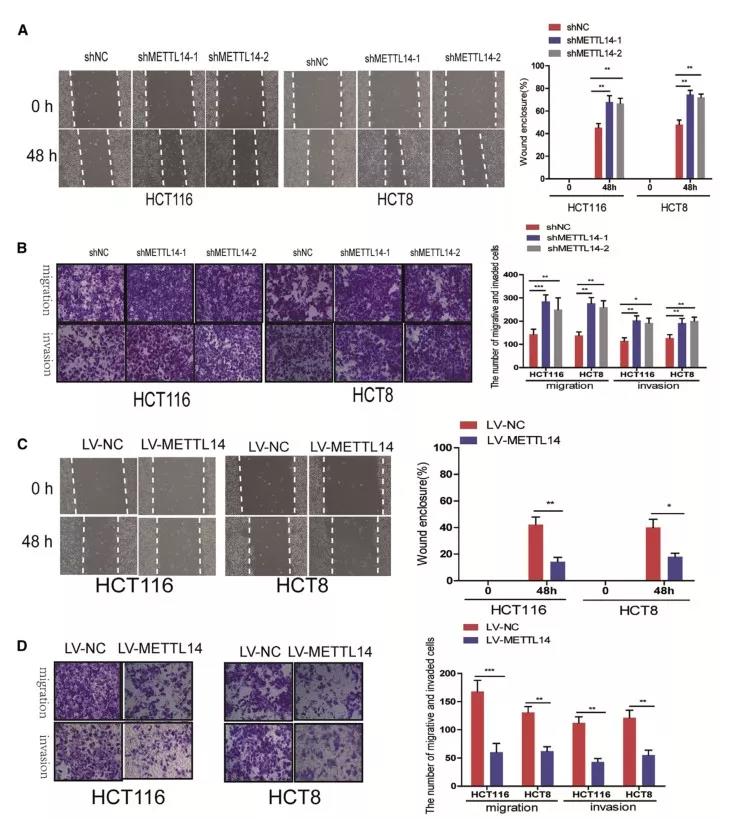
随后,探讨METTL14对CRC细胞迁移和侵袭的作用。实验结果发现,敲降METTL14后,HCT116和HCT8细胞的迁移和侵袭能力均有显著提高;与此相反,过表达METTL14明显抑制CRC细胞的迁移和侵袭。
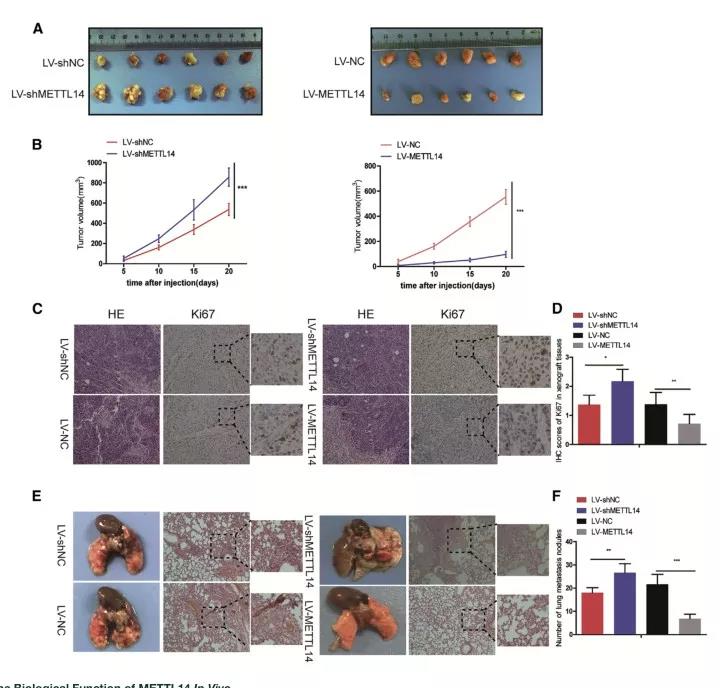
3、METTL14抑制体内CRC的生长和转移
接下来,作者进一步探究METTL14在体内的作用。首先在HCT116细胞中分别构建了METTL14敲降和过表达稳转株细胞,然后用这两种细胞构建了皮下异种移植模型。实验结果显示,METTL14敲降的异种移植瘤的生长明显受到促进,而METTL14过表达的移植瘤生长明显受到了抑制;同时,免疫组化实验结果显示,METTL14敲降增加了Ki67的表达,而METTL14过表达降低了异种移植组织中Ki67的表达水平。
此外,通过尾静脉注射HCT116细胞,建立裸鼠肺转移瘤模型。结果显示,METT14敲降组明显促进肺扩张,而METTL14过表达组明显抑制肺转移。
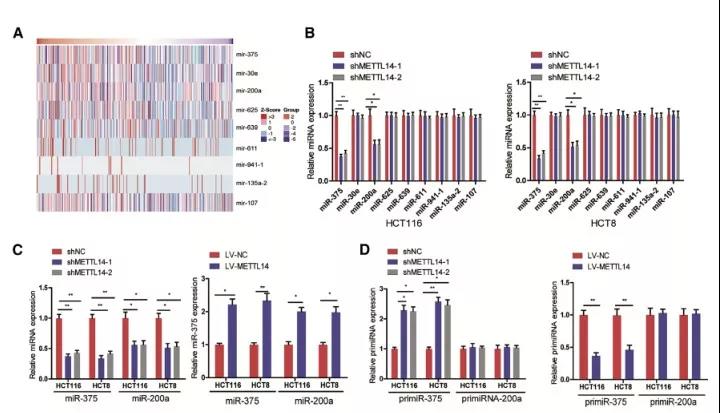
4、DGCR8通过依赖于METTL14的m6A甲基化调控miR-375
前面我们讲到,越来越多的研究证实METTL3或METTL14是DGCR8参与各种癌症的primiRNAs所必需的。作者因此探究在CRC中,DGCR8调控primiRNA的过程是否依赖于METT14/m6A。
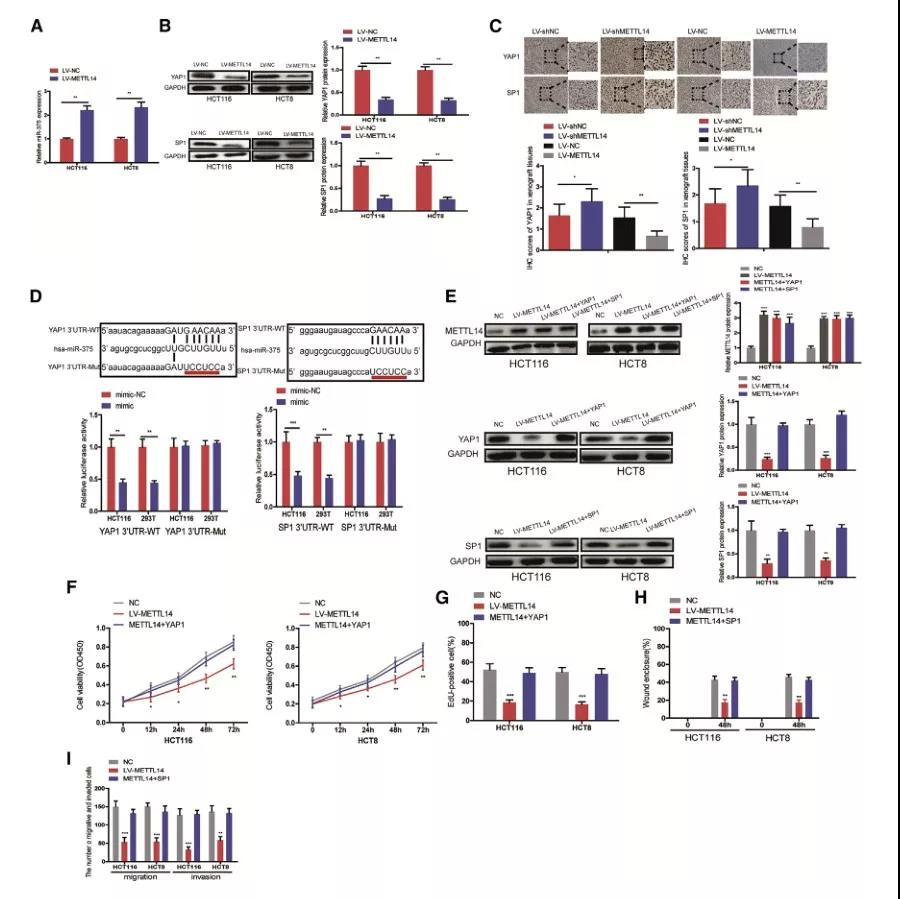
鉴于m6A水平的降低会导致primiRNA的过程停滞,并导致相应miRNA水平的降低,因此,METTL14/ m6a依赖的miRNA的表达与METTL14表达正相关;作者使用TCGA数据库分析网站LinkedOmics (http://www.linkedomics.org/login.php),发现9个miRNA在CRC组织中发现与METTL14呈正相关;随后,在METTL14敲降细胞株中检测这些miRNA的表达,发现miR-375和miR-200a表达下降,进一步检测两个miRNA前体形式primiR-375和primiR-200a 的表达,实验发现,primiRNA-375在METTL14敲降的CRC细胞中积累,在METTL14过表达的CRC细胞中下调,而primiR-200a没有明显变化。
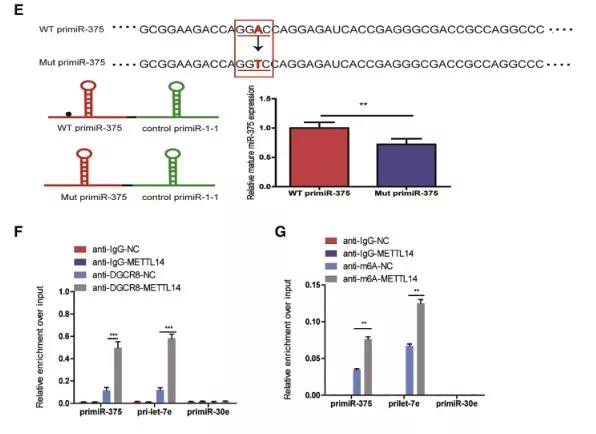
为了验证m6A修饰在primiR-375成熟过程中的直接作用,接下来,作者把其m6A修饰的位点突变,结果发现,primiR-375中m6A motif的突变显著地降低了其向成熟形态的加工。此外,免疫共沉淀实验结果显示,primiR-375与DGCR8结合的水平在METTL14过表达细胞中显著上升,同时,METTL14过表达明显增加了primiR-375 的m6A修饰水平。
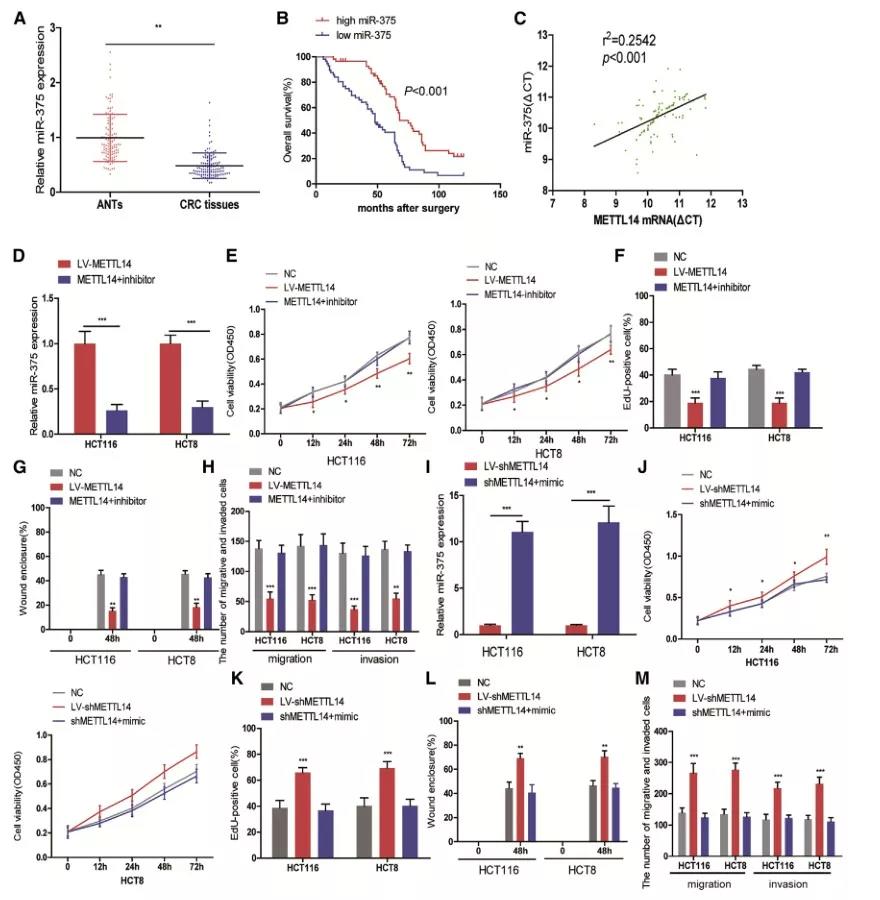
5、miR-375是METTL14的下游靶点
随后,作者进一步探讨miR-375作为METTL14的下游靶点,在CRC进展中的潜在分子机制,作者检测112对CRC组织和ANTs(癌旁组织)中miR-375的表达情况,结果显示,与相应的ANTs相比,CRC组织中miR-375明显降低,与METTL14呈正相关,且其下调与预后不良有关。
接下来,在METTL14过表达细胞中使用miR-375 inhibitor,下调miR-375的表达;并且发现抑制miR-375可以恢复细胞下降的增殖、迁移和侵袭能力;类似的,在METTL14敲降细胞中上调miR-375的表达,以及一系列的回复实验,实验发现,mir -375的表达能够逆转METTL14敲低对细胞增殖、迁移和侵袭的影响。
6、METTL14通过miR-375/YAP1和miR-375/SP1通路抑制CRC进展
众所周知,miR-375是一种重要的癌症相关miRNA,许多致癌基因已被证实为miR-375的功能靶点,包括YAP1、SP1、AEG1、PDK1、IGF1R和JAK2。
在这里,我们发现METTL14过表达明显升高miR-375的表达,并且降低YAP1和SP1的表达,免疫组化结果与此一致,而METTL14敲降增加了异种移植组织中YAP1和SP1的表达水平。因此,作者推测METTL14可能通过miR-375/YAP1和miR-375/SP1通路发挥其生物学功能。为了验证这个假设,作者使用荧光素酶报告系统检测miR-375和其下游靶标的结合关系,在293T 和 HCT116 细胞中,过表达miR-375后,WT组荧光水平下降,而MUT组荧光水平不变;
此外,作者在METTL14过表达细胞中转入YAP1和SP1过表达质粒,并进行了一系列的回复实验,实验结果显示,YAP1提高了细胞的增殖能力,SP1提高了细胞的迁移和侵袭能力。这些结果表明METTL14通过miR-375/YAP1和miR-375/SP1通路抑制CRC进展。
结语
METTL14在CRC组织和细胞系中下调,并且与总生存率(OS)密切相关。METTL14的下调显著降低了总RNA中m6A的水平,促进了CRC细胞的生长和转移,而METTL14的过表达则显著提高了总RNA中m6A的水平,并起到抑制CRC细胞生长和转移的作用。此外,作者证实了miR-375是METTL14的下游靶点。并且,METTL14通过miR-375/YAP1通路抑制CRC细胞生长,以及通过miR-375/SP1通路抑制CRC细胞的迁移和侵袭。
参考文献:
1. Chen Xiaoxiang,Xu Mu,Xu Xueni et al. METTL14 Suppresses CRC Progression via Regulating N6-Methyladenosine-Dependent Primary miR-375 Processing.[J] .Mol. Ther., 2020, 28: 599-612.
2. Alarcón, C.R., Lee, H., Goodarzi, H., Halberg, N., and Tavazoie, S.F. (2015). N6-
methyladenosine marks primary microRNAs for processing. Nature 519, 482–485.
3. Ma, J.Z., Yang, F., Zhou, C.C., Liu, F., Yuan, J.H., Wang, F., Wang, T.T., Xu, Q.G.,
Zhou, W.P., and Sun, S.H. (2017). METTL14 suppresses the metastatic potential of
hepatocellular carcinoma by modulating N 6 -methyladenosine-dependent primary
MicroRNA processing. Hepatology 65, 529–543.



 返回列表
返回列表