 2019.08.28
2019.08.28  2026次
2026次
近几年肠道菌群已成为医学和生命科学研究中极其重要的热点领域。目前认为肠道菌群是一个“隐形器官”,是人体的“第二大脑”,是一个“内分泌器官”,与我们身体的其他器官有着密切的联系,参与人体生命活动的各个途径,包括食物消化和营养吸收、脂肪储存、某些维生素和非必需氨基酸的合成、药物代谢,血管生成、免疫系统的发育和成熟、神经调节、病原菌抵抗、上皮损伤修复、骨骼生成及骨代谢等,有近90%的疾病都有可能与肠道菌群相关。

来自香港中文大学,北京军区总医院的研究团队发现结肠直肠癌(CRC)的患者体内消化链球菌(Peptostreptococcus anaerobius)丰度显著增加,并进一步探讨了P anaerobius是否有助于小鼠结肠肿瘤的形成及其可能的致癌机制。
研究技术路线如下:
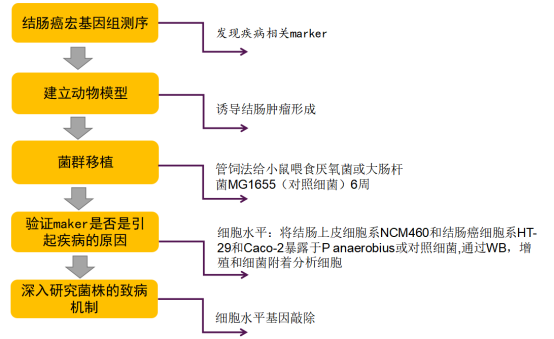
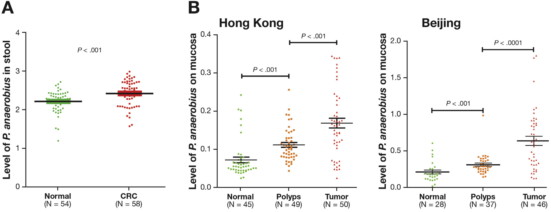
作者首先通过宏基因组及16s测序发现Panaerobius丰度在CRC患者体内显著升高,并用q-PCR的方法验证了58名CRC患者和54名对照的112份粪便样本中P anaerobius的丰度。证实,CRC患者的粪便样本中Panaerobius的丰度显著高于健康对照组;对来自香港中文大学的50个CRC,45个腺瘤和49个正常对照结肠活检样本以及北京军区总医院的6个CRC,37个腺瘤和28个正常对照结肠活检样本进行q-PCR验证均发现Panaerobius的表达水平在结肠癌患者中显著升高(如下图所示)。
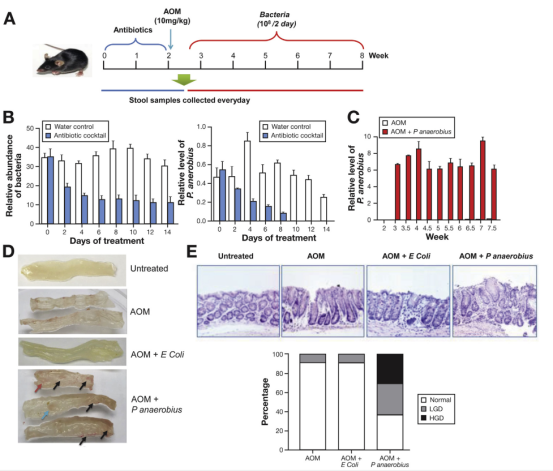
紧接着,作者采用氧化偶氮甲烷(AOM)诱导结肠肿瘤,各组给予抗生素混合物(antibiotic cocktail)后小鼠粪便样品中的总细菌及P.anaerobius水平显著降低,P.anaerobius喂养后小鼠粪便样品中P.anaerobius水平显著升高。肉眼观察及HE染色观察发现高丰度P.anaerobius可诱导小鼠结肠肿瘤的形成。该部分通过体内实验证实Panaerobius可促进小鼠的结肠肿瘤发生。
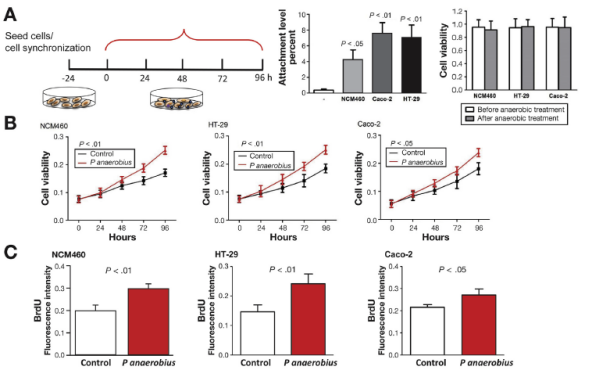
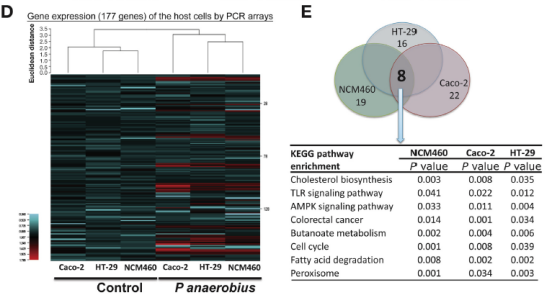
作者进一步开展体外实验,将Panaerobius与NCM460,HT-29和Caco-2细胞共培养,发现Panaerobius可促进细胞增殖,并通过芯片测序发现Panaerobius处理后胆固醇生物合成,TLR信号传导,AMP活化蛋白激酶信号传导,CRC,丁酸代谢,细胞周期,脂肪酸降解和过氧化物酶体信号传导8条通路显著富集。
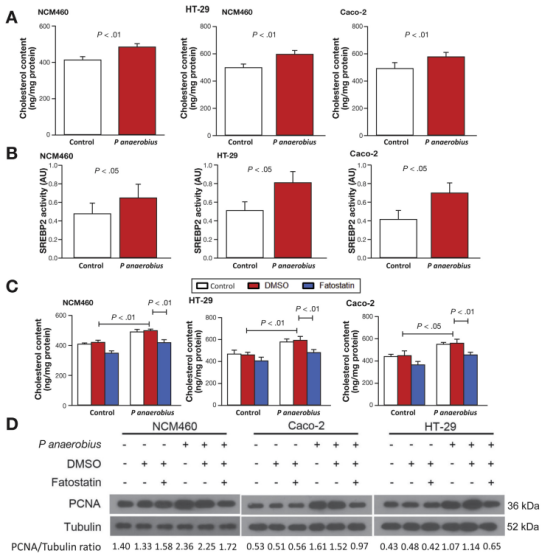
作者通过体内外实验证实了Panaerobius可促进细胞增殖,诱导结肠癌形成。其作用的具体机制呢?前面测序发现Panaerobius影响胆固醇生物合成,因此,作者下面设计如下实验通过胆固醇含量检测、SREBP2活性检测、WB检测PCNA蛋白及Brdu实验证实Panaerobius可上调NCM460,HT-29和Caco-2细胞中胆固醇水平,且依赖甾醇调节元件结合蛋白-2(SREBP2)促进细胞增殖。
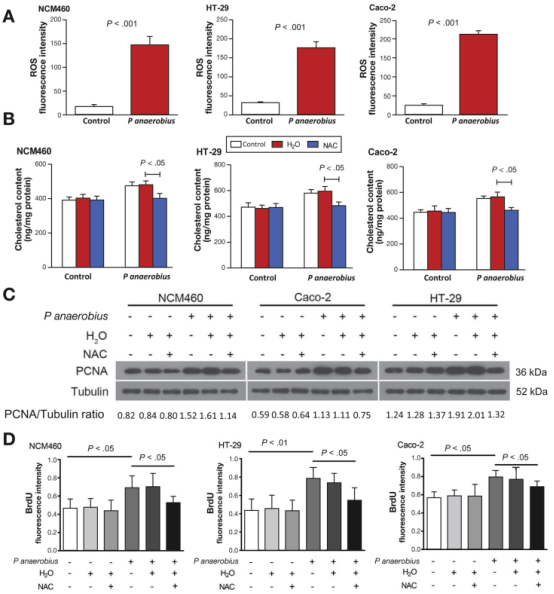
机制做到这里并没有结束,作者根据前面测序的结果提出科研假设:P anaerobius是否通过与TLR信号相互作用,导致细胞内ROS水平的增加、胆固醇水平升高进而促进细胞增殖?首先通过如下实验证明Panaerobius诱导细胞内ROS升高,用ROS的清除剂N-乙酰基-L-半胱氨酸(NAC)处理后细胞内胆固醇水平降低,并通过WB检测PCNA蛋白及Brdu实验证明Panaerobius通过诱导细胞内ROS升高、促进胆固醇生物合成并促进细胞增殖。
其次,作者合成TLR2 siRNA及TLR4 siRNA,并转染到NCM460,HT-29和Caco-2细胞中,发现细胞内ROS水平,胆固醇水平均显著降低,WB及Brdu实验证明加入ROS清除剂NAC后细胞增殖均显著降低。进一步说,ingP anaerobius诱导ROS产生促进胆固醇生物合成及细胞增殖依赖于TLR信号。
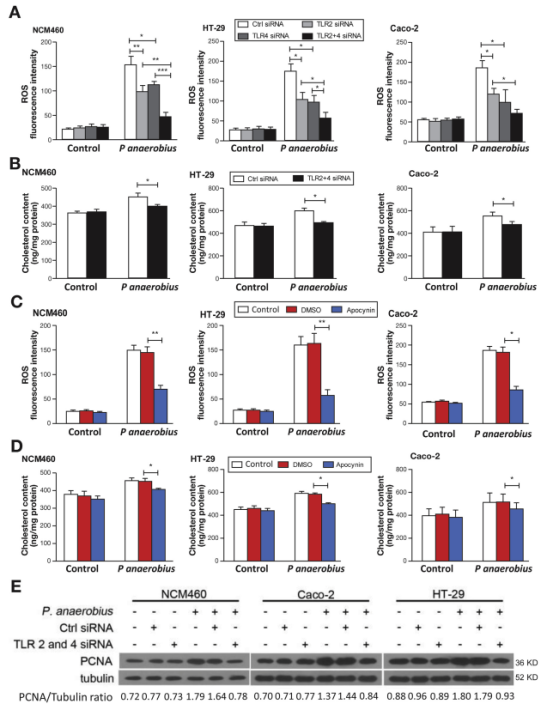
最后,作者通过体内实验再次证明,与对照组比较Panaerobius治疗后小鼠体内胆固醇水平和SREBP2活性显著升高,结肠组织中的PCNA蛋白表达显著升高。
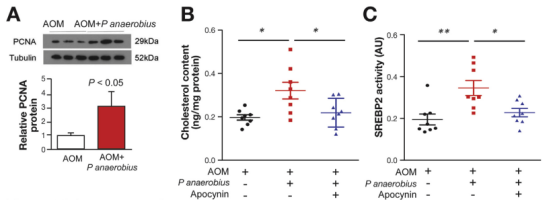
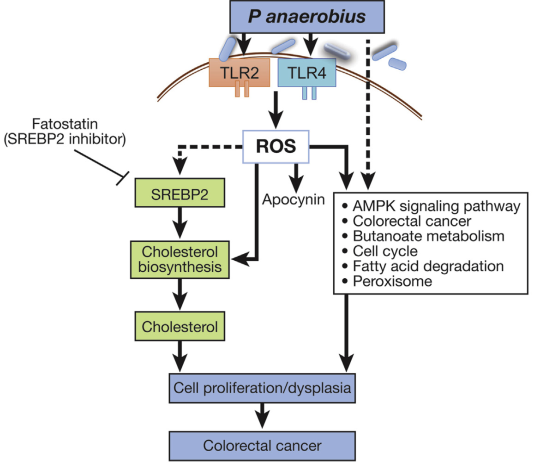
总之,通过本研究发现Panaerobius在体内定植增加可能使宿主易于发生结肠直肠癌。作者阐明了Panaerobius在结直肠癌发生的作用机制:即通过与宿主细胞上的TLR2/4相互作用来介导Panaerobius的作用以诱导ROS产生,并通过调节SREBP2来增加胆固醇生物合成,激活前致癌因子、促进CRC的发生(如下图所示)。这些发现有可能为CRC的预防,诊断和治疗提供参考。



 返回列表
返回列表